(7分)钢铁是使用最多的金属材料。
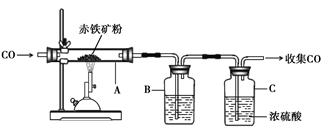
(1)下图为实验室炼铁的装置图,A中反应的化学方程式是 ;将反应后的气体通过装置B和C,收集较纯净的CO并循环使用,B中应盛放的试剂是 浓溶液。
(2)工业上可用酸清洗锈蚀的金属。将生锈的铁片和生锈的铜片[铜锈的成分Cu2(OH)2CO3]同时放入一定量盐酸中,可能发生的化学反应有:
①铜锈溶解:Cu2(OH)2CO3+ 4HCl= 2CuCl2 + 3X + CO2↑,则X的化学式为 ;
②铁锈溶解:化学方程式为 ;
③有金属单质生成:化学方程式为 。
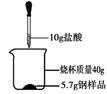
(3)某化学小组欲测定一种钢样品中铁的含量,实验操作如图所示,实验结果记录如下表:
| 反应时间 | t0 | t1 | t2 | t3 |
| 烧杯和药品质量/g | 55.7 | 55.6 | 55.5 | 55.5 |
②有同学提出,灼烧可使钢中的碳转化为二氧化碳,钢样品质量会减轻。但是他们将一定量的钢样品灼烧后,发现质量反而增加了,其原因是 。
(1)3CO + Fe2O3 3CO2 +2 Fe 氢氧化钠(或NaOH)
3CO2 +2 Fe 氢氧化钠(或NaOH)
(2)①H2O ② Fe2O3 + 6HCl = 2FeCl3 + 3H2O ③ CuCl2 + Fe =" Cu" + FeCl2
(3)①98.2%
②钢中含碳量少,所以碳减少的质量,远小于铁转化为氧化物时增加的质量
题目分析:(1)一氧化碳还原氧化铁的反应方程式为:3CO + Fe2O3 3CO2 +2 Fe;因反应生成了二氧化碳,要吸收二氧化碳,应该使用氢氧化钠浓溶液,B中应盛放的试剂是氢氧化钠浓溶液。
3CO2 +2 Fe;因反应生成了二氧化碳,要吸收二氧化碳,应该使用氢氧化钠浓溶液,B中应盛放的试剂是氢氧化钠浓溶液。
(2)①铜锈溶解:Cu2(OH)2CO3+ 4HCl= 2CuCl2 + 3X + CO2↑,根据质量守恒定律可知X的化学式为H2O;
②铁锈溶解:化学方程式为:Fe2O3 + 6HCl = 2FeCl3 + 3H2O;
③铁的活动性强于铜,有反应:CuCl2 + Fe =" Cu" + FeCl2;
(3)①由题中数据可知,反应停止后共计生成氢气0.2g,设这种钢样品中铁的质量是X。
Fe+2HCl=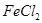 +
+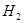 ↑
↑
56 2
X 0.2g
56:2=X:0.2g
X=5.6g
样品中铁的质量分数为: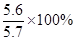 =98.2%。
=98.2%。
②有同学提出,灼烧可使钢中的碳转化为二氧化碳,钢样品质量会减轻。但是他们将一定量的钢样品灼烧后,发现质量反而增加了,其原因是钢中含碳量少,但是碳减少的质量,远小于铁转化为氧化物时增加的质量。
点评:书写化学方程式要遵循客观事实和质量守恒定律两个原则,注意化学式要正确,不要忘记反应条件、气体或者沉淀符号。
根据化学方程式计算,要注意解题的步骤,设、写、找、列、解、答。
