(20分)现有A、B、C、D、E、F六种短周期元素,原子序数依次增大。已知A与D、C与E分别同主族,D、E、F同周期;A、B的最外层电子数之和与C的最外层电子数相等,A与C形成的化合物常温下均为液态,A分别与E、F形成的气体分子电子总数相等。
请回答下列问题:
(1)元素B在周期表中的位置是___________,元素D的原子结构示意图为___________。
(2)A、D、E 3种元素形成一种离子化合物,其水溶液呈碱性,试用离子方程式表示该溶液中存在的所有平衡 。
(3)A2C比A2E沸点高的原因是 。
(4)在一定条件下,A、C的单质和A、C、D形成的离子化合物的水溶液可构成电池,该电池正极的电极反应式为 ,负极的电极反应式为 ;
(5)该电池在放电过程中,电解质溶液的pH将_________(填“增大”、“减小”或“不变”)。
化合物B2A4 和B2C4 的液体曾被用作火箭推进剂,燃烧反应的生成物是一种气态单质和一种化合物,它们对环境无污染。1 mol B2A4与B2C4完全反应生成两种气体时放出热量516.8 kJ,则该反应的热化学方程式为 。
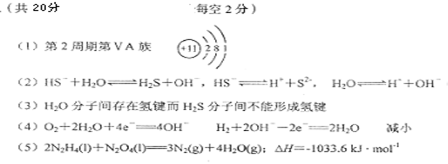
根据已知信息可以推出,A、B、C、D、E、F分别为氢元素、氮元素、氧元素、钠元素、硫元素和氯元素。这样,元素B在周期表中的位置是第二周期第VA族;(2)A、D、E 3种元素形成一种离子化合物,其水溶液呈碱性,则该离子化合物是硫氢化钠,该溶液中存在的所有平衡有,水的电离平衡,硫氢根的水解平衡和电离平衡;(3)H2O比H2S沸点高的原因是前者有氢键;(4)就是氢氧燃料电池,氢气在负极反应,氧气在正极反应,生成水,使氢氧化钠的浓度减低,碱性减弱,所以pH将减小;热化学方程式的书写是理综这几年常考的题型,书写时注意物质的状态,系数与焓变要对应,注意正负号。
