(13分)、短周期元素X、Y、Z、W、Q的原子序数依次增大,Y原子最外层电子数是次外层的2倍,X、W可分别与Z组成常见化合物X2Z、X2Z2、W2Z、W2Z2,Q的单质是常见的半导体材料。请回答:
(1)Y在元素周期表中的位置是 。
(2)X2Z的电子式是 。
(3)W2Z2与X2Z反应的化学方程式是 。
(4)上述元素中有两种非金属元素位于同一主族。能证明它们非金属性强弱的一个反应的化学方程式是 。
(5)在 25℃、101 kPa下,Q的气态氢化物在氧气中完全燃烧可得Q的最高价氧化物,反应中每转移1mol e-放热190.0 kJ。则该反应的热化学方程式是 。
(1)第2周期ⅣA族
(2) 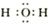
(3)2Na202+2H20=4NaOH+O2
(4)CO2+H20+Na2SiO3=Na2CO3+H2Si03(胶体)
(5)SiH4(g)+202(g)=Si02(s)+2H2O(l) AH=一1520.0 kJ/mol
Y原子最外层电子数是次外层的2倍可以确定Y元素是C,Q的单质是常见的半导体材料则Q为Si,X、W可分别与Z组成常见化合物X2Z、X2Z2、W2Z、W2Z2,常见的此类化合物由H2O,H2O2,Na2O,Na2O2可以判断X是H,Z是O,W是Na;
(1) C在周期表中的位置是第2周期ⅣA族
(2) X2Z是H2O,电子式是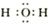
 (3)过氧化钠与水反应的方程式为2Na202+2H20=4NaOH+O2
(3)过氧化钠与水反应的方程式为2Na202+2H20=4NaOH+O2
(4)碳元素和硅元素位于同一主族,证明二者的非金属性强弱可以通过最高氧化物对应水化物的酸性大小进行比较,CO2+H20+Na2SiO3=Na2CO3+H2Si03(胶体),碳酸的酸性比硅酸强,说明碳的非金属性比硅强。
(5)Q的气态氢化物是SiH4,在氧气中燃烧时转移1mol e-放热190.0 kJ则可以得到有1mol SiH4参与反应时放出的热量为1520.0 kJ,所以热化学方程式为SiH4(g)+202(g)=Si02(s)+2H2O(l) AH=一1520.0 kJ/mol。
