(12分)第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。

请回答以下问题:
⑴认真分析上图中同周期元素第一电离能的变化规律,将Na——Ar之间六种元素用短线连接起来,构成完整的图像。
⑵从上图分析可知,同一主族元素原子的第一电离能I1变化规律是____________;
⑶上图中5号元素在周期表中的位置是__________________________;
⑷上图中4、5、6三种元素的气态氢化物的沸点均比同主族上一周期的元素气态氢化物低很多,原因是:_________________________________________________。
(5)同周期内,随原子序数增大,I1值增大。但个别元素的I1值出现反常现试预测下列关系式中正确的是__________。
①E(砷)>E(硒) ②E(砷)<E(硒) ③E(溴)>E(硒) ④E(溴)<E(硒)
(6)用氢键表示式写出HF溶液中存在的所有氢键_________________________________
(1)略(2分) (2)从上到下依次减小;(2分)
(3)第三周期,ⅤA族;(2分)
(4)因同主族上一周期的元素的氢化物分子间存在氢键;(2分) (5)①③(2分)
(6)F__H---F O___H---O F__H---O O__H---F (2分)
(1)Na——Ar之间六种元素第一电离能的变化规律为: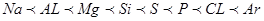 ;
;
(2)从上图分析可知,同一主族元素原子的第一电离能I1变化规律是:从上到下依次减小;
(3)上图中5号元素即P在周期表中的位置是第3周期第VA族;
(4)上图中4、5、6三种元素的气态氢化物的沸点均比同主族上一周期的元素气态氢化物低很多,原因是:同主族上一周期的元素的氢化物分子间存在氢键;
(5)同周期内,随原子序数增大,I1值增大。但个别元素的I1值出现反常现试预测下列关系式中正确的是:E(砷)>E(硒);E(溴)>E(硒);
(6)用氢键表示式写出HF溶液中存在的所有氢键为:F__H---F O___H---O F__H---O O__H---F
