(选修—物质结构与性质)(12分)
X、Y、Z三种元素,原子序数依次增大,它们的原子序数之和为43。其中,Y原子的最外层电子数是次外层电子数的三倍。X、Y元素的单质都是构成空气的主要成分。
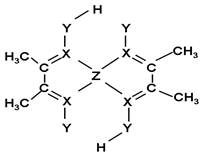
(1)Z原子的价层电子排布式为____________;XY3-离子的空间构型为__________。
(2)X单质与Y单质直接发生化合反应的化学方程式_________________________。
(3)ZO(氧化物)、FeO晶体结构类型均与NaCl的相同,Z2+和Fe2+离子半径分别为69pm和78pm,则熔点ZO_____ FeO(填“<”或“>” )。
(4)ZO晶体中Z2+的配位数为____________。
(5)化合物A常用于检验Z2+:在稀氨水介质中,A与Z2+
反应可生成鲜红色沉淀,其结构如图所示:
该结构中,碳碳之间的共价键类型是______(“σ键”
或“π键”);X与Z2+离子间形成的是配位键,在图
上标出配位键的电子给予的方向。
该结构中,Y原子与氢原子除了形成共价键外,
还可存在_______ ;
该结构中,碳原子的杂化轨道类型有_____;Y原子的杂化轨道类型为_____。
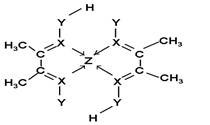
(1)由题意可知:X、Y、Z对应的元素分别为:N、O、Ni;Z原子的价层电子排布式为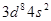 ;XY3-离子为
;XY3-离子为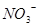 ,空间构型为平面三角形;
,空间构型为平面三角形;
(2)X单质与Y单质直接发生化合反应的化学方程式: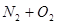
 ;
;
(3)(氧化物)、FeO晶体结构类型均与NaCl的相同,Z2+和Fe2+离子半径分别为69pm和78pm,则熔点ZO大于FeO;
(4)ZO晶体中Z2+的配位数为6;
(5)碳碳之间的共价键类型是σ键;Y原子与氢原子除了形成共价键外,还可存在氢键,该结构中,碳原子的杂化轨道类型有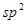 和
和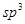 杂化;Y原子的杂化轨道类型为
杂化;Y原子的杂化轨道类型为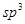 杂化;
杂化;
