(8分)下表由元素周期表的前三周期去掉副族上方的空白区域后组合而成,表中虚线处为ⅡA、ⅢA族的连接处,请用相应的化学用语或符号回答下列问题:
| a | |||||||
| b | c | d | e | f | |||
| g | h |
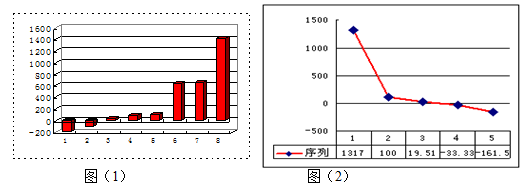
(1)上图(1)是表示第三周期8种元素单质的熔点(℃)柱形图,已知柱形“1”代表Ar,则其中柱形“8”代表的是 晶体(填晶体的类型)。
(2)b、c、d、e、f的氢化物的沸点(℃)直角坐标图(2),序列“5”的氢化物的名称是
,序列“2”的氢化物的结构式为 。
(3)e元素与f元素相比,电负性f大于e,下列表述中能证明这一事实的是 (填选项序号)
A.常温下f单质的颜色比e单质的颜色深
B.f单质与e的氢化物剧烈反应,产生e的单质
C.f与e形成的化合物中e元素呈正价态
D.比较两元素的单质与氢气化合时得电子的数目
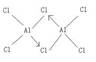
(4)科学家证实,氯化铝属于共价化合物,分子式为Al2Cl6,且每种元素均满足8电子的结构,请写出你认为正确的Al2Cl6结构是_______________。
(5)叠氮化物是一类重要化合物,在炸药、磁性化合物研究、微量元素测定方面越来越引起人们的重视,由叠氮化钠(Sodium azida)NaN3热分解可得光谱纯N2:2NaN3(s)→2Na(l)+3N2(g),有关说法正确的是_____________(选填序号)

A.钠晶胞结构如图,钠晶胞中每个钠原子的配位数为6
B.钠晶胞结构如图,晶胞中分摊2个钠原子
C.氮的电负性大于氧
D.Na+的半径小于N3-的半径
(1) 原子 (2) 甲烷, H-O-H (3) B 、 C
(4)
(5) B、D
根据题目结合元素周期表,可以推知a、b、c、d、e、f、g、h分别为H、Li、C、N、O、F、Na、Al,由熔沸点高低关系一般:原子晶体>离子晶体>分子晶体,第三周期中Si为原子晶体,故为Si,图2中,熔沸点最高的可能为离子晶体(金属氢化物),最低的为CH4。(4)AlCl3如果是共价化合物,Cl满足8电子稳定结构,Al为6个电子,Al2Cl6中都满足8电子,必然存在配位键。(5)从图中看出,钠晶胞中每个Na周围有8个钠,即配位数为8。晶胞中钠的个数用均摊法:1+8×=2,电负性:同周期从左往右,逐渐增大,N<O;Na+和N3-的电子层结构相同,核电荷数越多,半径越小,故Na+<N3-.。答案选BD。
