甲、乙、丙是由短周期元素形成的常见单质,丙在常温下为无色气体,且乙、丙两元素同主族,其余均为常见化合物,它们在一定条件下有如下转化关系(反应中生成的水已略去)。
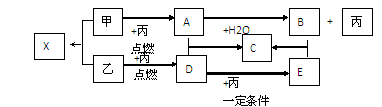
⑴C的化学式是 ;B中所含化学键的类型 。
⑵A+D→C的反应属于下列何种反应类型(填字母) 。
A.化合反应
B.氧化还原反应
C.非氧化还原反应
D.离子反应⑶写出甲与H2O反应的化学方程式: 。
⑷请用右图装置证明A和H2O反应是放热反应并有丙生成。
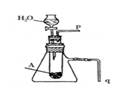
简述合理的实验操作方法:
① 。
② 。
(1) Na2SO4 ; 离子键和共价键 。
(2) AB 。
(3) 2Na + 2H2O =" 2NaOH" + H2 。
(4)① 将q插入水中,反应后q处冒气泡,证明反应放热 。
② 在p处收集气体,该气体能使带有余烬的木条复燃,证明是氧气 。
(其他合理答案均给分)
(1)高中阶段所学习的常温下的无色单质气体,而且还是短周期元素构成,那么物质丙的范围可缩小氢气,氧气,氮气三种,再整体观察,甲,乙两种单质均可以在丙中燃烧,并且乙变成D,D再变成E的过程中,丙都参与其中反应,这表明丙有很大可能是氧气。推测丙为氧气,那么乙和丙同主族又是常见单质,所以乙应该是硫单质,D可能为二氧化硫,E为三氧化硫。这样一来由乙到E的这条关系线就比较清晰了。再来推甲到丙的这条线,单质甲在丙中燃烧,生成的产物A可以与水反应放出丙,这一点可以看出单质甲是Na,A为Na2O2,与水反应生成的B就是NaOH,同时也断定丙肯定为氧气。剩余的物质C应该是 Na2SO4,X为Na2S。B中的化学键包括钠离子与氢氧根离子间的离子键,以及氢氧根中氢氧原子间的共价键。
(2)A与D的反应:Na2O2+SO2=Na2SO4属于化合反应,其中化合价发生变化,所以也属于氧化还原反应。
(3)2Na + 2H2O =" 2NaOH" + H2↑
(4)Na2O2与水反应,可以利用受热膨胀的常识进行验证,将q插入水中,反应后q处冒气泡,证明反应放热。至于氧气的验证,可以利用氧气使带火星木条复燃来验证。

