(11分,最后一空为2分,其余各1分)下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
(2)化学性质最不活泼的元素的原子结构示意图为
(3)元素的最高价氧化物对应的水化物中酸性最强的酸是 ,碱性最强的
碱是 呈两性的氢氧化物是 ;
(4)在③~⑦元素中,原子半径最大的是 ,原子半径最小的是 ;
(5)在⑦与⑩的单质中,氧化性强的是 ,可用什么化学反应说明该事实(写出反应的化学方程式):
(1)K F (2)Ar (3)HClO4KOH Al(OH)3 (4)Na Cl(5)Cl2 Cl2+2KBr=2KCl+Br2
(1)最容失去电子的元素应该在第一主族,根据元素周期律,可推断⑨号元素K最容易失去电子,非金属性最强的是在第七主族,②号元素F。
(2)化学性质最不活泼的元素应该在0族元素里,此图中唯一的0号元素Ar,原子结构示意图为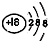 。
。
(3)最高价氧化物对应的水化物酸性强弱应该比较中心元素非金属性强弱,非金属性越强则对应的最高价氧化物水化物的酸性就越强(除F外),所以酸性最强的酸HClO4。碱性则应该看金属性强弱,所以应该是KOH。呈两性的应该是Al(OH)3。
(4)③~⑦元素是同一周期元素,在同一周期中,除0族外从左往右原子半径依次减小,所以原子半径最大的是③号Na,最小的是⑦Cl。
(5)⑦号元素Cl,⑩号元素Br,从与氢气反应的难易程度和所需条件,可推断氧化性较强的单质应该是Cl2,反应事实可用置换反应:Cl2+2KBr=2KCl+Br2,从该反应中利用规律,氧化剂氧化性大于氧化产物,可看出氧化性Cl2〉Br2。
