(16分)已知X、Y、Z、T四种元素中,只有T不是短周期元素,与它们有关部分信息如下表:

(1)Y元素位于周期表的第 周期 族;写出T基态原子电子排布式: 。
(2)X元素单质分子中含有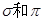 键的键数之比为 ,其化学性质 (填“活泼”或“稳定”):
键的键数之比为 ,其化学性质 (填“活泼”或“稳定”):
(3)对Z元素的单质或化合物描述一定正确的是 。
a.单质不溶于任何溶剂 b.其最高价氧化物的水化物为弱酸
c.其最高价氧化物常温下为气态d.气态氢化物不稳定
(4)上述四种元素中,其最高价氧化物的水化物呈两性的物质是 (填化学式),试用电离方程式表示其两性的原因 。
(5)已知:①4XH3(g)+5O2(g)=4XO(g)+6H2O(g) △H=-905kJ/mol
②4XH3(g)+3O2(g)=2X2(g)+6H2O(g) △H=-1268kJ/mol
写出X2与O2反应生成XO的热化学方程式 。
(16分)
(1)第三周期,ⅢA族;[Ar]3d64s2
(2)1:2 ,稳定 (3) d
(4)Al(OH)3 H2O+AlO2-+H+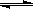 Al(OH)3
Al(OH)3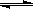 Al3++3OH-
Al3++3OH-
(5)N2(g)+O2(g)=2NO(g) △H=+181.5kJ/mol (每空2分)
根据题意知X、Y、Z、T分别为N、Al、Si或S(原子核外有五种不同能量的电子,
表明有五个能级,即1s2s2p3s3p,最外层有2个未成对电子表明3p上有2个或4个电子)、
T为Fe,X元素单质为N2分子中含有N≡ N,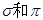 键分别有1个、2个,键能大其化学性
键分别有1个、2个,键能大其化学性
质稳定;Z元素的单质可以是硫或硅,而硫可溶于二硫化碳,硫酸为强酸,最高价氧化物二
氧化硅或三氧化硫常温下为固态,氢化物:H2S、SiH4均不稳定,所以(3)选d;上述四种
元素,最高价氧化物的水化物呈两性的物质是Al(OH)3,电离方程式:H2O+AlO2-+H+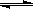
Al(OH)3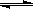 Al3++3OH-
Al3++3OH-
(5)(①-②)/2得N2(g)+O2(g)=2NO(g) △H=+181.5kJ/mol。
