问题
计算题
称取铜、锌混合物粉末10.0 g置于烧杯中,慢慢加入稀硫酸使其充分反应,直至固体质量不再减少为止,此时用去49.0 g稀硫酸。剩余固体3.5 g。
(1) 该混合物粉末中铜的质量分数为多少?
(2) 充分反应后生成氢气的质量是多少?
答案
(1)35.0%
(2) 0.2g
题目分析:(1)根据金属活动性顺序可知,金属铜不与稀硫酸反应,故反应剩余固体3.5g即为铜的质量,故该混合物粉末中铜的质量分数为:3.5g/10.0g ×100%="35.0%" ;
(2)混合物中锌粉的质量为10.0g-3.5g=6.5g
设充分反应后生成氢气的质量是x
Zn+H2SO4=ZnSO4+H2↑
65 2
6.5g x
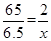
解得x=0.2g
点评:根据金属的活动性,分析题中所发生的反应,判断出所余固体为铜,此为本题的突破口。
