(17分)
A、B、C、D、E是位于前三周期的五种元素,原子序数依次增大,其中B与D为同一主族元素,它们可形成化合物DB2、DB3。在同周期元素中,C的金属性最强,E的非金属性最强。请回答:
(1)E的原子结构示意图为。
(2)A、B形成的原子个数比为1∶1的化合物的电子式为,该化合物与DB2化合生成一种强酸的化学方程式为。
(3)已知在一定条件下1 mol气态DB2完全转化为气态DB3,放出98.3 kJ的热量。该反应的热化学方程式是,工业上进行这一反应的设备是。
(4)用铂做电极电解由C、E形成化合物的饱和溶液时,检验阳极产物的实验方法为;电解一段时间后,将阳极产物和阴极溶液混合,反应的离子方程式是。工业中实际常采用阳离子交换膜电解槽进行电解,若某一电极由碳钢网制成,则该电极为电解槽的 (填“阴”或“阳”)极。

在前三周期中同一主族元素能够形成DB2、DB3 结构化合物的元素只有氧和硫,形成的化合物是SO2和SO3 所以可以判断B元素为氧,D元素为硫,A、B、C、D、E原子序数依次增大可判断E在第三周期,又E得非金属性同周期中最强,第三周期中非金属性最强的是氯,所以E为氯。C的金属性最强可判断C为钠。
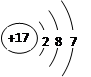
(1)E的原子结构示意图为
(2)A可与氧原子形成1∶1的化合物且A的原子序数小于6则A为氢,形成的化合物为过氧化氢电子式为
 ,过氧化氢与二氧化硫反应的方程式为H2O2+SO2=H2SO4
,过氧化氢与二氧化硫反应的方程式为H2O2+SO2=H2SO4
(3)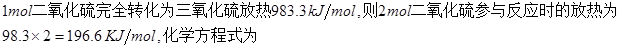
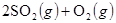


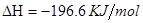
工业上该反应是在接触室内进行的。
(4)C、E形成化合物为氯化钠,电解饱和食盐水阳极产物为氯气,检验方法为用湿润的淀粉碘化钾试纸靠近该气体,若试纸变蓝则说明为氯气;阴极产物为氢氧化钠,氯气与氢氧化钠反应的离子方程式为
 。碳钢网应该放在阴极,因为阴极是一个的电子的电极,若将碳钢网至于阳极,因为阳极失去电子,会导致碳钢网收到腐蚀,所以碳钢网放在阴极。
。碳钢网应该放在阴极,因为阴极是一个的电子的电极,若将碳钢网至于阳极,因为阳极失去电子,会导致碳钢网收到腐蚀,所以碳钢网放在阴极。