某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究。
【产品与原理】该厂采用“侯氏制碱法”生产化工产品--纯碱(Na2CO3)和化肥NH4Cl。
生产原理是:将NH3和CO2通入饱和食盐水中得到NaHCO3和NH4Cl的混合物,反应为:NaCl(饱和)+NH3+CO2+H2O==NaHCO3↓+NH4Cl;分离出NaHCO3,加热制得纯碱。
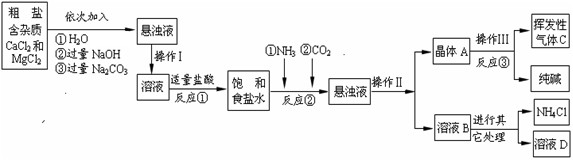
【生产流程】
【相关资料】⑴NH4Cl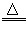 NH3↑+HCl↑
NH3↑+HCl↑
⑵ 已知20℃时有关物质的溶解度如下(气体指1体积水中能溶解的气体体积)

【问题讨论】⑴操作Ⅰ、Ⅱ、Ⅲ中,相同操作的名称为_______________。
⑵反应①中发生了两个反应,写出其中的一个化学方程式:______________________。
⑶反应③中得到纯碱的化学方程式为:____________________。
⑷溶液B中的溶质有________(至少写出两种)。
⑸上述生产流程中可循环使用的是________(填序号)。
A.挥发性气体C B.溶液D C.氢氧化镁 D.化肥NH4Cl
【组成确定】⑴称取一定质量的纯碱样品,经多次充分加热后,再称重,质量无变化;
⑵另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀。
由上述实验可确定纯碱样品含有杂质__________(写化学式)。
【含量测定】称取纯碱样品10.8g加入适量水,再加入过量CaCl2溶液,搅拌、过滤、洗涤、干燥后称得固体质量为10.0g,请通过计算并结合下表判断此纯碱样品等级为______品。

【总结反思】某同学认为,在上述纯碱含量测定中,将CaCl2溶液改为BaCl2溶液,测定误差会减小,其理由是_________________。
【问题讨论】⑴ 过滤
⑵ NaOH+HCl==NaCl+H2O或Na2CO3+2HCl=2NaCl+H2O+CO2↑
⑶ 2NaHCO3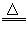 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
⑷ NaHCO3、NaCl、NH4Cl、NH4HCO3四种中的任意两种,(写名称或名称符号混写也可)
⑸ A、B
【组成确定】NaCl
【含量测定】合格
【总结反思】等质量的碳酸钠与BaCl2反应产生的沉淀质量大,称量时的(相对)误差小(其他意思相近的表述,也可)
