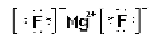问题
填空题
(21分)下表是元素周期表的一部分,回答有关问题。
| ⅠА | ⅡА | ⅢА | ⅣА | ⅤА | ⅥА | ⅦА | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | 11 | 12 |
(2)在这些元素的最高价氧化物对应的水化物中,酸性最强的是(均用化学式填写) 、碱性最强的是 ,呈两性的氢氧化物是 ,写出三者之间两两相互反应的离子方程式
(3)在这些元素中,原子半径最大的是 —、原子半径最小的是 (均用元素符号填写)
(4)写出②与④形成化合物的电子式 ;写出①单质的电子式 ;
答案
(1)钾 氟 氩(每空1分)
(2)HClO4 KOH Al(OH)3
H+ + OH -= H2O 3H+ + Al(OH)3 = Al3+ + H2O
OHˉ+ Al(OH)3 = [Al(OH )4]ˉ(每空2分)
(3) K F (每空1分)
(4)氟化镁的电子式;氮气的电子式(每空2分)
(1)题可以根据元素周期律,同周期从左到右元素金属性逐渐减弱,非金属性逐渐增强,同主族元素从上到下元素金属性逐渐增强,非金属性逐渐减弱,得出相应答案。
(2)题可以由最高价氧化物对应水化物的酸性和碱性强弱的判断依据,即非金属性越强酸性越强,金属性越强碱性越强。
(3)依据电子层数越多半径越大,电子层数相同时,原子序数越大半径越小得出答案。
(4)