问题
选择题
某合金6g与足量的稀硫酸充分反应后,如果生成0.2g氢气,该合金中的元素可能是
A.Zn和Fe
B.Cu和Au
C.Zn和Cu
D.Mg和Al
答案
答案:A
题目分析:假设该合金是纯金属,且其化合价为+2价,根据其生成氢气0.2g,可求得它的相对原子质量为60。现在它为合金,那就意味着组成该合金的两种金属的相对原子质量一个比60大,另一个比60小。据此可判断答案选A。运用此法解题时应注意以下两点:一是像铜、金等一类与酸不反应的不活泼金属,它们的相对原子质量应认为无穷大;二是化合价非+2价的应进行相应折算。如铝化合价为+3,相对原子质量为27,我们认为在此处铝的相对原子质量是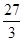 ×2=18
×2=18
