(8分)元素在周期表中的位置,反映了元素的原子结构和元素的性质。右图是元素周期表的一部分。
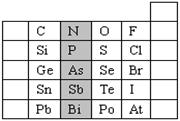
(1)阴影部分元素N的最高价氧化物为 。根据元素周期律,请你预测:H3AsO4、H3PO4 的酸性强弱:
H3AsO4 H3PO4。(用“>”、“<”或“=”表示)
(2)元素S的最高正价和最低负价分别为 、 ,
(3)羰基硫(COS)分子结构与二氧化碳分子结构相似,所有原子的最外层都满足8电子结构。请写出羰基硫分子的电子式
(4)单质砷和热的浓H2SO4反应,生成As2O3,反应的化学方程式为_________ ;
(8分)(1)N2O5 < (2)+6 -2 (3)
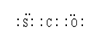
(4) 2As+3H2SO4(浓) As2O3+3SO2↑+3H2O
As2O3+3SO2↑+3H2O
⑴阴影部分为第ⅤA元素,最高价为+5,由上到下非金属性逐渐减弱,最高价含氧
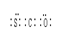
酸酸性减弱,因此N的最高价氧化物为N2O5,H3AsO4<H3PO4。
⑵S为第ⅥA,S的最高正价和最低负价分别为+6、-2,
⑶二氧化碳分子结构为直线型,碳与每个氧形成两对电子对,则羰基硫分子的电子式为
⑷单质砷和热的浓H2SO4反应,生成As2O3,则H2SO4被还原为SO2,
反应式为2As+3H2SO4(浓) As2O3+3SO2↑+3H2O
As2O3+3SO2↑+3H2O
