(2013安徽)“五一”假期,小兵对“锌与硫酸反应快慢的影响因素”进行了探究。
【提出问题】锌与硫酸反应的快慢受哪些因素的影响呢?
【猜想与假设】a.可能与硫酸的质量分数有关;b.可能与锌的形状有关。
【设计并实验】小兵用不同质量分数的硫酸和不同形状的锌进行如下实验。
| 实验编号 | 硫酸的质量分数(均取20mL) | 锌的形状(均取1g) | 氢气的体积(mL)(均收集3分钟) |
| ① | 20% | 锌粒 | 31.7 |
| ② | 20% | 锌片 | 50.9 |
| ③ | 20% | 锌粒 | 61.7 |
| ④ | 30% | 锌片 | 79.9 |
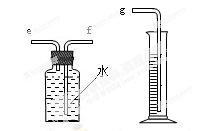
(2)小兵用右图装置收集并测量氢气的体积,其中量筒的作用是_______________________,氢气应从_______(填e或f或g)管通入。
【收集证据】(3)要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是____________。
【得出结论】(4)结论是_______________________________________________________。
【评价与反思】(注意:若答对(5)(6)两小题奖励4分,化学试卷总分不超过60分)
(5)下表是小兵第①组实验的详细数据。
| 时段(均为1分钟) | 第1分钟 | 第2分钟 | 第3分钟 | 第4分钟 | 第5分钟 | 第6分钟 |
| H2的体积 | 3.1mL | 16.7mL | 11.9mL | 9.6mL | 7.6mL | 6.0mL |
(6)锌与硫酸反应的快慢可能还受哪些因素影响?设计实验验证_______________________________。
(1) Zn+H2SO4=ZnSO4 +H2 ↑
(2)根据进入量筒中水的体积,判断生成氧气的体积; F
(3)①③或②④
(4)硫酸的质量分数越大,反应速率越快_锌与硫酸的接触面积越大,反应速率越快
(5)由慢到快然后逐渐减慢;随着反应的进行,硫酸被消耗,硫酸溶质质量分数变小
(6)温度;取质量相等的锌粒分别放入两只试管中,然后分别加入溫度不同,体积和溶质质重分数相同的稀硫酸,测重收集等体积的氢气所需要的时间。(只要考生有控制变量的意识即可)
题目分析:(1)根据“活泼金属与酸反应生成盐和氢气,属于置换反应”进行书写.该反应为初中化学常见的反应
(2)因为气体的密度要小于水的密度,所以应从f通入氢气,将水从e排出.再通过通过测量排出水和体积来判断氫气的体积.因为排出水和体积等于通入氢气的体积.以此为依据进行解答
(3)因为要比较不同质量分数的硫酸对反应快慢的影响,即硫酸的质量分数应为变量,其他量不变。所以应选择硫酸质量分数不同,锌状态相同的两组进行对比。故可选①③或②④
| 实验编号 | 硫酸的质量分数(均取20mL) | 锌的形状(均取1g) | 氢气的体积(mL)(均收集3分钟) |
| ① | 20% | 锌粒 | 31.7 |
| ③ | 30% | 锌粒 | 61.7 |
| ② | 20% | 锌片 | 50.9 |
| ④ | 30% | 锌片 | 79.9 |
③④相比可知,硫酸的质量分数越大,反应速率越快.
(5)根据表中数据可知,第1分钟最慢,第2分钟最快,其后减慢.所以反应是先由慢转快再变慢.随着反应的进行,硫酸越来越少,反应物的浓度也随着变小,反应速度因此下降.
(6) —般可影响反应速度的因素有:反应物的颗粒大小(状态)、反应物的浓度、温度、是否有催化剂等。可选其一进行解答.在解答过程中,注意控制变量。如探究溫度对反应速度的影响,其中可变量是温度.其它量不变
