某回收站回收的废金属粉末中含锰(Mn)、金(Au)、铜三种金属。为了回收贵重金属,回收站将有关三种金属随意编号为:A、B、C,并设计了如下回收流程:
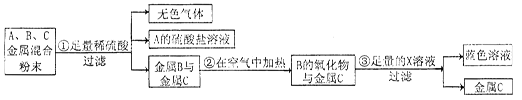
(1)A、B、C三种金属的活动性顺序为: > >
(2)C是 ;B的氧化物的化学式是: 。
(3)已知A的硫酸盐中A元素显+2价,请写出步骤①的反应的化学方程式: 。
(4)你认为步骤③中所加入的X溶液是 。
(5)欲直接从蓝色溶液中制得金属B,可选用的试剂是 (填标号)。
a.氢氧化钠溶液 b.氯化钠溶液 c.稀盐酸 d.铁
(1)A B C (2) Au CuO
(3) Mn + H2SO4 =MnSO4 + H2↑ (4) 稀硫酸 (5)d
题目分析:(1)A能与稀硫酸反应,说明A排在氢的前面,而金属C在空气中加热都不会与氧气反应,说明化学性质稳定,所以A、B、C三种金属的活动性顺序为:A>B>C
(2)金的化学性质稳定,在空气中加热也不会与氧气反应,所以C是Au,B自然是Cu,它的氧化物化学式为:CuO
(3)金属与酸反应生成盐和氢气,已知A的硫酸盐中A元素显+2价,所以反应的化学方程式:Mn + H2SO4 =MnSO4 + H2↑
(4)要将氧化铜变为蓝色溶液,应加入稀硫酸,得到蓝色的硫酸铜溶液,化学方程式为:CuO+H2SO4=CuSO4+H2O
(5)要把硫酸铜溶液中的铜置换出来,应加入一种活动性比铜强的金属,故选d,方程式为:Fe+CuSO4=Cu+FeSO4
