“过 氧化钠(Na2O2)”是一种淡黄色固体,能与水或二氧化碳反应放出氧气。实验室有一瓶放置了较长时间的过氧化钠粉末,已知发生了部分变质,同学们取3.00g变质粉末决定探究其中的成分及其质量。

【提出问题】变质的过氧化钠粉末中有哪些成分,它们的质量是多少?
【查阅资料】 ①2Na2O2+2H2O═4NaOH+O2↑ ;2Na2O2+2CO2═2Na2CO3+O2
②碳酸钠溶液显碱性,氯化钙溶液显中性。
③Na2CO3+ CaCl2═CaCO3↓+2 NaCl
【猜想与假设】(1)粉末成分是Na2O2和NaOH的混合物
(2)粉末成分是______________________的混合物
(3)粉末成分是Na2O2、NaOH 和Na2CO3的混合物 ……
【设计实施方案】
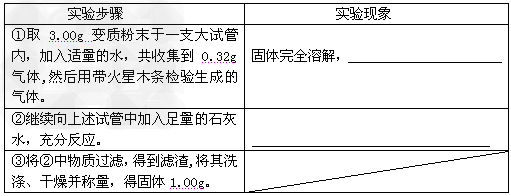
【解释与结论】同学们经过认真分析,得出了以下结论。
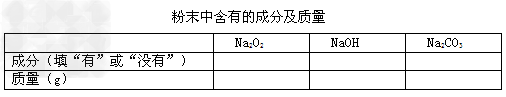
【反思与评价】(1)实验室在保存过氧化钠时应注意_______________。
(2)有同学提出把第②步实验中足量的石灰水改为足量氯化钙溶液,至沉淀不再生成时过滤,向滤液中滴加无色酚酞试液,若液体变红,则证明原粉末中有NaOH。你认为该方案是否合理并说明理由____________________________。
【猜想与假设】(2)Na2O2 和Na2CO3
【设计实施方案】
【解释与结论】 
【反思与评价】(1)密封保存(隔绝水或二氧化碳)
(2)不合理,因为过氧化钠与水反应也能生成氢氧化钠,也能使无色酚酞试液变红,所以,不能证明原粉末中有NaOH。
