现有A、B、C、D、E、F六种短周期元素,原子序数依次增大。已知A与D、C与E分别同主族,D、E、F同周期;A、B的最外层电子数之和与C的最外层电子数相等,A与C形成的化合物常温下均为液态,A分别与E、F形成的气体分子电子总数相等。请回答下列问题:
(1) 元素B在周期表中的位置______________。
(2) A2C比A2E沸点高的原因是____________________________。
(3)写出同时含A、B、C、E四种元素的三种盐的化学式 、 、 。
(4)A2C的电子式为 ,C和D形成的一种化合物与A2C发生氧化还原反应,该反应的离子方程式为
(5)B元素的最高价氧化物的水化物与其氢化物反应的离子方程式
(6)在一定条件下,A、C的单质和A、C、D形成的离子化合物的水溶液可构成电池,该电池在放电过程中,电解质溶液的pH将________(填“增大”、“减小”或“不变”)。
(共10分方程式2分其余每空1分)
(1) 第二周期第VA族
(2) H2O分子之间能形成氢键
(3)NH4HSO3、 (NH4)2SO4、NH4HSO4、 (NH4)2SO3(任写3种)
(4) 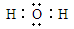 ,2Na2O2+2H2O=4Na++4OH- +O2 ↑(2分)
,2Na2O2+2H2O=4Na++4OH- +O2 ↑(2分)
(5) NH3+H+=NH4+
(6) 减小
在推断元素过程中,“A与C形成的化合物常温下均为液态”是突破口即H2O、H2O2,A、B、C、D、E、F六种短周期元素分别为H、N、O、Na、S、Cl。具体答案见解析。
