某化学兴趣小组通过如下实验由废铁屑制备硫酸亚铁晶体(FeSO4·7H2O ):
①在洗涤过的废铁屑中加入适量稀硫酸,反应结束后过滤。
②将滤液转入到密闭容器中,静置、冷却析出硫酸亚铁晶体。
③待结晶完毕后,滤出晶体,用少量低温的水洗涤晶体3 次。
请回答下列问题:
(1 )在步骤①过滤时,所需用到的玻璃仪器中,除了漏斗、烧杯外,还需
(2 )写出步骤①中发生反应的化学反应方程式
(3 )步骤③中洗涤晶体用的水必须少量且低温,其原因是
(4 )为了判断步骤③中晶体表面吸附的硫酸是否洗净,有人向第3 次洗涤液中滴加硝酸钡溶液和稀硝酸,得到白色沉淀,以此证明该晶体并未洗净。该结论是否可靠?为什么?
(1 )玻璃棒
(2 )Fe+H2SO4=FeSO4+H2↑
(3 )因为晶体易溶于水,温度越低,溶解度越小,用水越少,晶体损失越少.
(4 )不可靠;不论是否洗干净,洗涤液中一定含有SO42-

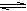 2SO3(g)并达到平衡,在此过程中,甲维持容器的体积不变,乙维持容器的压强不变,若甲中SO2的转化率为a%,则对乙中SO2的转化率的合理描述为下列的 ( )
2SO3(g)并达到平衡,在此过程中,甲维持容器的体积不变,乙维持容器的压强不变,若甲中SO2的转化率为a%,则对乙中SO2的转化率的合理描述为下列的 ( )