金属用途广泛,其结构和性质等是化学的重要研究内容。
(1)生铁和钢都是铁的合金,但是性质上有很大的差异,这是因为 ,钢铁制品在生活中用途广泛,但却易生锈,写出一种防止铁锅生锈的做法 。
(2)铝比铁活泼,但铝在空气重表现出良好的抗腐蚀性,为什么?
(3)为了探究X、Y、Z三种固体金属的活动性,将X和Y浸入稀硫酸中,Y溶解并产生氢气,X无变化,将X和Z浸入硝酸银溶液中X表面有银析出而Z无变化。根据以上事实回答:
①X、Y、Z三种金属的活动性由强到弱的顺序为
A.X Y Z
B.Y X Z
C.Z X Y
D.X Z Y②写出金属X的化学式
(4)铜以及铜合金的应用有着悠久的历史。现有黄铜(铜、锌合金)20g,放入烧杯中,加入50g的稀盐酸,恰好完全反应,测得烧杯内剩余物质的质量为69.6g。请计算黄铜样品中锌的质量分数。
(1)含碳量不同;保持铁锅表面干燥
(2)常温下易和氧气反应生成致密的氧化膜起保护作用
(3)B Cu
(4)65%
题目分析:(1)生铁和钢都是铁的合金,主要通过含碳量的高低来区分,含量在0.2-1.7%的叫钢,含量在1.7%以上的叫生铁,则生铁中含碳量高;铁在有水和氧气并存时易生锈,防锈的方法就是使铁锅隔绝氧气或水:如保持铁锅干燥清洁,用完擦干后涂油等;
(2)铝容易与空气中的氧气发生反应,会生成一层致密的氧化铝膜覆盖在铝的表面,可以阻止里面的铝进一步被氧化,所以具有良好的抗腐蚀性。
(3)Y能与稀H2SO4反应而X不能,推知Y的活动性大于X的活动性;由“X和Z浸入AgNO3溶液中,X表面有Ag析出而Z无变化”推知:X的活动性大于Ag,而Z的活动性小于Ag,综上所述则有X、Y、Ag 、Z三种金属的活动性由强到弱的顺序为Y>X>Ag>Z;选用的X,其活动性要排在H与Ag之间即可,如Cu、Hg等;
(4)黄铜中的锌与稀硫酸反应生成氢气而铜不与稀盐酸反应;根据质量守恒定律计算出氢气的质量,然后再根据化学方程式中锌与氢气的重量比关系求解锌的质量;黄铜20g,进而求得黄铜中锌的质量分数。
解:设样品中Zn的质量为x
氢气的质量=20g+50g-69.6g=0.4g
Zn+2HCl=ZnCl2+H2↑
65 2
x 0.4g
 =
=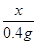
x=13g
样品中锌的质量分数=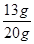 ×100%=65%
×100%=65%
答:样品中锌的质量分数为65%
