(16分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语
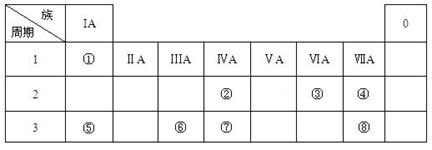
回答下列问题:
(1)④、⑤、⑥的原子半径由大到小的顺序为_______________________,②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是______________________。
(2)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)_________________。
a.MnO2 b.FeCl 3 c.Na2SO3 d.KMnO4
若已知1 克该液态化合物分解成③的单质和一种常见液体时,可放出2.9kJ能量,写出该反应的热化学方程式:
(3)工业上常采用电解A和冰晶石(Na3AlF6)混合物的方法冶炼制备⑥的单质,请从A晶体的类型和微粒间的相互作用力角度解释加冰晶石(Na3AlF6)的原因 。 并写出电解时的电极反应式: 。
(4)甲、乙、丙是上述部分元素组成的双原子分子或负二价双原子阴离子,且甲、乙、丙的电子总数相等。甲是一种极强的氧化性单质。丙与⑤的阳离子可形成一种淡黄色固体B,该固体跟水反应可得到③的单质。则B电子式 ,乙的结构式 ,甲的组成元素的原子结构示意图 ,能证明甲的组成元素非金属性很强的事实 。(任举一例即可)
(1)Na>Al> F HClO4>H2CO3>H2SiO3
(2) a b 2H2O2(l)=2H2O(l)+O2(g) ΔH=-197.2kJ·mol-1
(3)氧化铝为离子晶体,破坏离子键需要较多的能量,加冰晶石能降低熔点
阳极:2O2——4e-=O2 阴极 Al3++3e—=Al
(4) 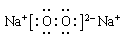 H—Cl
H—Cl 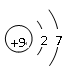 与H2在暗处就能化合或HF很稳定
与H2在暗处就能化合或HF很稳定
考查周期表的结构和元素周期律的应用。根据元素在周期表中的相对位置可以得出,①是氢元素,②碳元素,③氧元素,④氟元素,⑤钠元素,⑥铝元素,⑦硅元素,⑧氯元素,⑨硫元素。