(9分)A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A与D同主族;C与E同主族;B、C同周期;B原子最外层电子数比其次外层电子数多2;A是周期表中半径最小的元素,C的最外层电子数是内层电子的3倍;F元素是同周期元素中原子半径最小的主族元素。A、B、C、D、E形成的化合物甲、乙、丙、丁的组成如下表所示:
| 化合物 | 甲 | 乙 | 丙 | 丁 |
| 化学式 | A2C | A2C2 | D2C2 | D2E |
(1)写出下列元素名称:A ;指出元素F在周期表中的位置的 。
(2)化合物乙的电子式为 ,用电子式表示形成化合物丁的过程 。
(3)写出丙与甲反应的化学方程式:
(4)固体氧化物燃料电池是以固体氧化锆—氧
化钇为电解质,这种固体电解质在高温下允
许O2-在其间通过,该电池的工作原理如下图所示,其中多孔Pt电极a、b分别是气体C2、A2的载体。①该电池的负极为 (填a或b);O2-流向 极(填“正极”或“负极”)
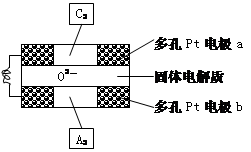
②该电池的正极反应为 ,
负极反应为 。
(1)氢;( 1分) 第3周期VIIA族(1分)
(2)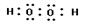 ;
; 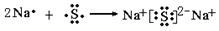 ;(每空1分)
;(每空1分)
(3)2Na2O2 + 2H2O ="=4NaOH" +O2↑
(4)①b,负;(每空1分)②O2+4e-=2O2-,H2 - 2e- = 2H+(每空1分)
B的核外电子排布为:2 4,则B是碳元素;A是氢元素;C的核外电子排布为:2 6,则C是氧元素,D是钠元素,E是硫元素,F是氯元素;化合物甲、乙、丙、丁依次为:H2O、H2O2、Na2O2、Na2S;
(2)氢、氧均为非金属元素的原子,非金属元素的原子间易形成共价键;
(4)构成氢、氧燃料电池,则(-)H2 - 2e- = 2H+ (+) O2 +4e- ="2" O2-,
电子从(-)沿导线流向(+),则溶液中传递负电荷的O2-应移向(-),从而形成闭合回路;
