根据下图四个化学实验,回答问题:(提示:Cu与Zn的合金称为黄铜)
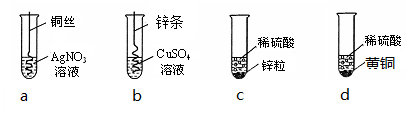
(1)描述实验a中的实验现象 。
(2)要证明Cu、Zn、Ag的活动性顺序,必须要做的实验是 (填实验序号)。
(3)在c实验后的剩余溶液中,一定有的溶质是 ,可能有的溶质是 ,为了确定可能有的溶质,可加入 (填选项序号)
Ⅰ.氯化钡溶液 Ⅱ.氢氧化铜 Ⅲ.氢氧化钠溶液 Ⅳ.锌粒
(4)为了测定d中稀硫酸的溶质质量分数,取20g该黄铜样品于烧杯中,向其中分4次加入该稀硫酸,充分反应。每次所用稀硫酸的质量及剩余固体的质量记录于下表:
| 加入稀硫酸的质量(g) | 充分反应后剩余固体的质量(g) | |
| 第1次 | 25 | 16.75 |
| 第2次 | 25 | 13.5 |
| 第3次 | 25 | m |
| 第4次 | 25 | 12.0 |
试回答下列问题:
Ⅰ.上述表格中m的值为 ;
Ⅱ.该稀硫酸的溶质质量分数是多少?(根据化学方程式计算)
(1)铜片表面有银白色物质析出
(2)a b
(3)ZnSO4 H2 SO4 ⅡⅣ
(4)12
题目分析:根据金属活动性顺序的应用,位于氢前面的金属能把酸中的氢置换出来生成氢气;位于前面的金属能把位于后面的金属从化合物的溶液中置换出来;锌与硫酸反应生成的是硫酸锌,故溶质一定有硫酸锌,可能还有硫酸;硫酸能是氢氧化铜溶解,能与锌反应生成气体。
设H2 SO4x mol
20-16.75/65=0.05
Zn + H2 SO4→ ZnSO4+H2↑
1 1
0.05 mol x mol
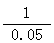 =
= 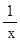 x =" 0.05" mol
x =" 0.05" mol
0.05×98/25=0.196(或19. 6%)
