对实验室制取CO2反应后滤液的相关探究
(1)块状石灰石和适量稀盐酸反应至气泡逸出不明显后,过滤,测得滤液的pH=2。则滤液呈 ___________性,滤液中所含的主要离子有________________。
(2)因后续实验需要,现要配制质量分数为26.5%的碳酸钠溶液200g
①计算:需要碳酸钠固体的质量为___________g;水的体积为__________mL(水的密度近似看作1g/cm3)
②称量:调节托盘天平平衡后,将__________放在托盘天平的左盘,称量其质量。 然后在右盘添加__________。最后加碳酸钠固体,直至天平平衡。
③溶解:用量筒量取所需的水,倒入装有碳酸钠固体的烧杯里,用玻璃棒____________,使其溶解,并冷却至室温。
④存储:把配好的溶液装入试剂瓶,塞好橡皮塞并___________,放到指定的地方。
(3)取50g滤液,逐滴滴入上述配制的碳酸钠溶液,并用pH数字探测仪连续监测,得曲线如下[pH为纵坐标,时间s(秒)为横坐标]:
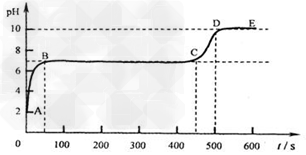
①写出AB段内有关化学方程式____________ ,_______________,_______________。
②写出BC“平台”段现象____________。
③CD段上升的原因是:__________________ 。
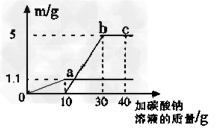
(4)根据上述实验测得的另一组数据绘制出下图(纵坐标m是实验得到的沉淀或气体的质量,横坐标表示的是碳酸钠溶液质量),请计算出原滤液中氯化钙的质量分数。
(1)酸 ; H+ 、Ca2+、Cl-
(2)①53 ;147;②烧杯砝码;③搅拌;④贴上标签
(3)①Na2CO3+2HCl=2NaCl+ H2O+CO2↑ ;CaCO3+2HCl=CaCl2+H2O+CO2↑;
Na2CO3+CaCl2= CaCO3↓+2NaCl ;②出现白色沉淀;③碳酸钠溶液呈碱性,过量的碳酸钠溶液使溶液碱性增强
(4)11.1%
