(12分) A-E六种元素中,除A外均为短周期元素,它们的原子结构或性质如表所示:
| 序号 | 元素 | 结构或性质 |
| ① | A | 生活中常见的金属,它有两种氯化物,相对分子质量相差35.5 |
| ② | B | 原子最外层电子数是内层电子数的1/5 |
| ③ | C | K层和M层上电子数之和等于L层上电子数 |
| ④ | D | 与B同周期,且最外层电子数等于电子层数 |
| ⑤ | E | 1—20号元素中原子半径最大(除稀有气体外) |
(2)分别由A、B、D、E所形成的简单离子中,具有还原性的离子是 ,氧化性最弱的离子是 。(填离子符号)
(3)D的最高价氧化物对应水化物常用于治疗胃酸(含盐酸)过多症,请写出有关反应的化学方程式 。
(4)证明物质中含有E元素的方法是:用洁净的铂丝棒蘸取少量含E元素的物质在酒精灯上灼烧,能够观察到 色火焰。
(5)B与D形成的合金是工业上重要的材料。写出该合金在工业上的一个用途 。某同学仅使用天平和右图所示的装置测定某些数据即可求出该合金中B元素的含量。
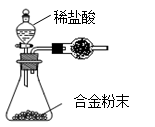
①实验需要测定三个物理量:合金的质量m、a和b。
a是反应前装置和药品的总质量;
b是 ;
②干燥管中盛放的试剂最好是 。
③合金中B元素的质量分数是 (用m、a、b表示)。
(1)(2分) 2Al + Fe2O3高温 2Fe + Al2O3(2)(各1分) Fe2+, K+
(3)(2分) Al(OH)3+3H+=Al3++3H2O (4)(1分)显紫色。
(5)①(1分) b是反应后装置和药品的总质量 ②(1分)碱石灰(或其他碱性干燥剂)
由题意可知:A、B、C、D、E对应的元素分别为: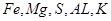 ;
;
(1)工业上利用AL单质与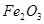 A的一种红色氧化物反应,在野外焊接钢轨,其化学方程式为:2Al + Fe2O3高温 2Fe + Al2O3;
A的一种红色氧化物反应,在野外焊接钢轨,其化学方程式为:2Al + Fe2O3高温 2Fe + Al2O3;
(2)分别由A、B、D、E所形成的简单离子分别为: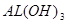 ;具有还原性的离子是Fe2+,氧化性最弱的离子是K+;
;具有还原性的离子是Fe2+,氧化性最弱的离子是K+;
(3)D的最高价氧化物对应水化物为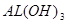 ,常用于治疗胃酸(含盐酸)过多症,其方程式为:Al(OH)3+3H+=Al3++3H2O
,常用于治疗胃酸(含盐酸)过多症,其方程式为:Al(OH)3+3H+=Al3++3H2O
(4)证明物质中含有K元素的方法是:用洁净的铂丝棒蘸取少量含E元素的物质在酒精灯上灼烧,能够观察到火焰呈紫色;
5)①b是反应后装置和药品的总质量 ②碱石灰(或其他碱性干燥剂)
