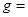(13分)有A、B、C、D、E五种短周期元素, 它们的原子序数依次增大。已知A和B原子具有相同的电子层数, 且A的最外层电子数是次外层电子数的两倍, C是该周期中原子半径最大的元素, C的单质在加热下与B的单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物,E与D相邻。试根据以上叙述回答:

 (1)元素名称: A C __________ E
(1)元素名称: A C __________ E

 (2)写出AB2与过量氢氧化钠溶液反应的离子方程式 ;
(2)写出AB2与过量氢氧化钠溶液反应的离子方程式 ;
 写出 C2B2与AB2反应的化学方程式
写出 C2B2与AB2反应的化学方程式
 ;
;

 (3)画出D的原子结构示意图 ,
(3)画出D的原子结构示意图 ,

 用电子式表示化合物 C2D 的形成过程 ;
用电子式表示化合物 C2D 的形成过程 ;
 (4)D、E的气态氢化物的稳定性 大于 (填化学式)。
(4)D、E的气态氢化物的稳定性 大于 (填化学式)。
(1)碳、钠、氯 (各1分,共计3分)
(2)CO2+2OH-=H2O+CO32- (2分)
2CO2+2Na2O2=2Na2CO3+O2↑(2分)
(3)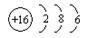

(各2分,共计4分)
(4)HCl H2S (各1分,共计2分)
最外层电子数是次外层电子数的两倍的元素只有C元素,即A是C,则B位于第二周期。C是该周期中原子半径最大的元素,而C的原子序数又大于A和B的,所以C是第三周期元素,则为Na。钠的化合物呈淡黄色的是过氧化钠,因此B是氧元素。而在单质中呈淡黄色的是硫元素,所以D是S。E与D相邻,原子序数大于D,又属于短周期元素,所以E是Cl。

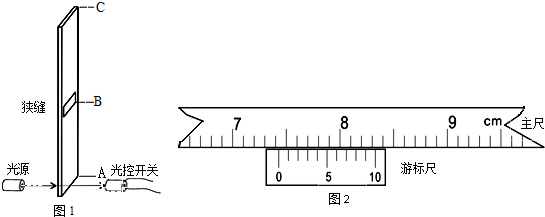
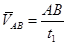 ,
,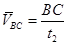 求出
求出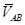 和
和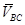 后,
后,