问题
实验题
硫酸亚铁是一种重要的化工原料,用途十分广泛.如医疗上可用于治疗缺铁性贫血;农业中可施用于缺铁性土壤等.某校化学兴趣小组,利用工业废铁屑为原料,设计如下两种制备硫酸亚铁的方案:
①Fe+H2SO4=FeSO4+H2↑
②2FeO+4H2SO4(浓)=Fe2(SO4)3+SO2↑+4H2O
Fe+Fe2(SO4)3=3FeSO4
(1)两种方案都有一定的理论依据,他们选用了方案①,那么不用方案②的理由是_________;
(2)工业废铁屑常沾有油污,去除油污的方法是_________;
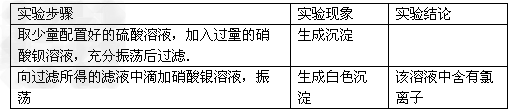
(3)他们在配制所需的稀硫酸时使用了自来水,小明提出自来水中含有少量的Cl﹣,会影响到制出的FeSO4的纯度.请你设计实验证明已配制的稀硫酸中混有Cl﹣;

(4)实验过程中,如何判断方案①的反应已停止 _________ ;
(5)利用工业废铁屑为原料制备硫酸亚铁的现实意义是 _________ .
答案
(1)过程复杂,有污染性气体污染环境,用到浓硫酸安全性小;
(2)用氢氧化钠等强碱性溶液浸泡;
(3)
(4)无气泡继续生成;
(5)实现废物再利用、提高资源的利用效率.
