(9分)日常生活中人们广泛使用金属材料。
(1)下列关于金属材料的说法正确的是 (填字母序号)。
A.铝是人类最早利用的金属材料
B.铜是目前世界年产量最高的金属
C.大多数金属元素在自然界中以单质形式存在
D.日常使用的金属材料大多数是合金
(2)选择铸造硬币的材料不需要考虑的因素是 (填字母序号)。
A. 金属的导电性 B. 金属的耐腐蚀性
C. 金属的硬度 D. 金属价格与硬币面值的吻合度
(3)以上硬币涉及到Fe、Cu、Al、Ni(镍),已知Ni能够发生如下反应:
Ni+ H2SO4= NiSO4+ H2↑ Fe+ NiCl2=" Ni" + FeCl2
这两个反应的基本类型都是 。四种金属活动性由强到弱的顺序为 (用元素符号表示)。
(4)工业炼铁可以把赤铁矿(主要成分为Fe2O3 )在高炉里和CO反应,生成单质铁,该反应的化学方程式是 ;
①氧化铁(Fe2O3)的相对分子质量是 ;
②2000t含氧化铁84%的赤铁矿中理论上可炼得含铁98%的生铁 t。
(1)D(1分),(2)A(1分),(3)置换反应(1分),Al、Fe、Ni、Cu(1分)
(4)Fe2O3+ 3CO==== 2Fe+ 3CO2(2分) 160(1分),1200t(2分)
题目分析:(1)A.人类最早利用的金属材料是铜,此项不正确。B.目前世界年产量最高的金属是铁,此项不正确。C.大多数金属元素在自然界中以化合物的形式存在,此项不正确。D.日常使用的金属材料大多数是合金。,此项正确。所以应选D项。
(2)选择铸造硬币的材料不需要考虑金属的导电性,所以应选A项。
(3)这两个反应的基本类型都是置换反应。根据反应可知Ni的活动性大于氢,小于铁。所以四种金属的活动性顺序为:Al、Fe、Ni、Cu。
(4)Fe2O3和CO反应,生成铁和二氧化碳。反应的化学方程式为:Fe2O3+ 3CO高温2Fe+ 3CO2;
①氧化铁(Fe2O3)的相对分子质量为:56×2+16×3=160;
②可根据铁元素的质量在冶炼过程中是守恒的,可计算出矿石中铁元素的质量,即为生铁中铁元素的质量,进一步求出冶炼出生铁的质量。具体过程为:
答:可冶炼出铁的质量为:2000t×84%×(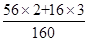 ×100%)÷98%=1200t
×100%)÷98%=1200t
