(8分)A、B、C三种元素的原子具有相同的电子层数,而B的核电荷数比A大1,C原子的电子总数比B原子的电子总数多4; 1molA的单质跟足量盐酸反应,可置换出标准状况下22.4L的H2,这时A转变为与氖原子具有相同电子层结构的离子。请回答:
(1)用电子式表示A和C组成的化合物的形成过程为______________________;
(2)B离子的电子式是 ,与B的离子具有相同电子数的分子中,有一种分子可与盐酸化合生成盐,该分子的电子式是 ;
(3)周期表中与C上下相邻的同族元素形成的气态氢化物中,沸点最高的是 ,(填氢化物化学式),原因是 ;
(4)写出B最高价氧化物的水化物和C最高价氧化物的水化物之间反应的离子方程式(本题涉及的含C元素的物质均易溶于水): 。
(1) 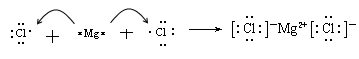
(2) Al3+ 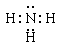
(3) HF HF分子之间存在氢键 (4)Al(OH)3+3H+=Al3++3H2O
标准状况下22.4L的H2的物质的量是1mol,反应中转移的电子是2mol,所以1molA在反应中失去2mol电子,即A离子的化合价是+2价。由于A离子和氖原子具有相同电子层结构,所以A的原子序数是12,即A是镁元素。则B是铝元素,C是氯元素。
(1)镁和氯属于活泼的金属和非金属,形成的化学键是离子键,电子式为
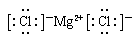 。
。
(2)金属阳离子的电子式就是就是阳离子符合。Al3+是10电子微粒,在10电子微粒中能与盐酸化合生成盐的分子是氨气,电子式为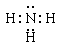 。
。
(3)F是最活泼的非金属元素,在HF中含有氢键,所以其沸点高。
(4)B最高价氧化物的水化物和C最高价氧化物的水化物分别是氢氧化铝和高氯酸,所以反应的离子方程式为Al(OH)3+3H+=Al3++3H2O。
