某工厂用电解饱和食盐水的方法生产氯气、烧碱、氢气等化工产品( 反应的化学方程式:2NaCl+2H2O  2NaOH+H2↑+Cl2↑),这种工业称为“氯碱工业”。某研究性 学习小组对该厂生产的烧碱样品进行如下探究。
2NaOH+H2↑+Cl2↑),这种工业称为“氯碱工业”。某研究性 学习小组对该厂生产的烧碱样品进行如下探究。
Ⅰ.定性探究
【提出问题】烧碱样品中可能含有哪些杂质?
【猜 想】
猜想一:可能含有Na2CO3,作出此猜想的依据是______________(用化学方程式表示)
猜想二:可能含有NaCl,作出此猜想的依据是 __________________ (用简洁的文字表述)
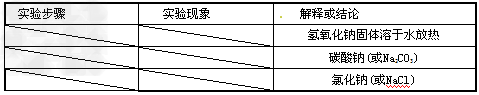
【设计实验】
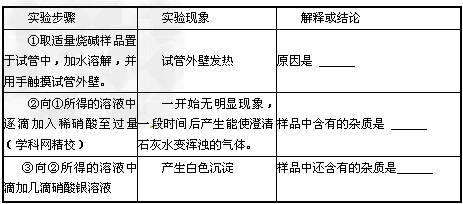
【交流与讨论】小明同学提出:“上述实验中稀硝酸也可以用稀盐酸代替”。你认为他的观点 ___ ( 填“正确”或“不正确”) 。
Ⅱ.定量探究
【提出问题】烧碱样品中氢氧化钠的质量分数是多少呢?
【设计实验】小婉同学设计探究方案后进行实验并测得数据如下:
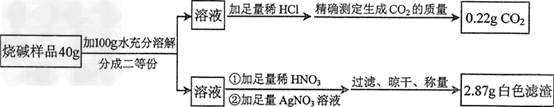
请你利用小婉同学测得的数据计算烧碱样品中氢氧化钠的质量分数( 请列出计算过程) 。
【交流与反思】小强同学认为小婉同 学设计的探究方案不够严密,其理由是:
学设计的探究方案不够严密,其理由是:
(1)探究方案中未考虑氢氧化钠的吸水性。
(2)探究方案中因缺少 ______ (填操作名称),导致测得的氢氧化钠的质量分数偏小。
Ⅰ.2NaOH+CO2==Na2CO3+H2O;氢氧化钠从电解后的溶液中析出时有少量未反应的氯化钠同时析出;
不正确;
Ⅱ.解:设20g样品中含Na2CO3质量为x,NaCl的质量为y。
Na2CO3+2HCl==2NaCl+H2O+CO2↑ NaCl+AgNO3==AgCl↓+NaNO3
106 44 58.5 143.5
x 0.22g y 2.87g
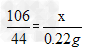
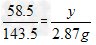
x=0.53g ,y=1.17g
氢氧化钠的质量分数= 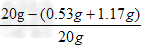 ×100%=91.5%
×100%=91.5%
答:烧碱样品中氢氧化钠的质量分数为91.5% ;
洗涤