(12分)下表是元素周期表的一部分,列出了七种元素的周期表中的位置:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ① | ② | ③ | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ |
(1)这七种元素中,非金属性最强的是 ,在元素周期表中的位置
(2)元素①与②形成摩尔质量为44g /mol的物质,它的电子式是
(3)③、⑥、⑦三种元素的原子半径由大到小的顺序是 。
(4)④元素最高价氧化物对应的水化物与⑥元素的最高价氧化物对应的水化物反应的化学反应方程式是
(5)④、⑤、⑥三种元素最高价氧化物的水化物碱性强弱顺序是
(1)F 第2周期ⅦA(2)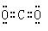 (3)Al>Cl>F
(3)Al>Cl>F
(4)NaOH+ Al(OH)3 Na[Al (OH)4](5)NaOH> Mg(OH)2> Al(OH)3
考查元素周期表的结构和元素周期律的应用。根据元素在周期表中的位置可知①是C,②是O,③是F,④Na,⑤是Mg,⑥是Al,⑦是Cl。
(1)同周期元素自左向右金属性之间减弱,非金属性逐渐增强。同主族元素自上而下金属性逐渐增强,非金属性逐渐减弱。
(2)元素①与②形成摩尔质量为44g /mol的物质是CO2,含有极性键。
(3)同周期元素自左向右原子半径逐渐减小,同主族元素自上而下原子半径逐渐增大。
(4)④元素最高价氧化物对应的水化物与⑥元素的最高价氧化物对应的水化物分别是氢氧化钠和氢氧化铝,氢氧化铝是两性氢氧化物,可溶于强碱。
