(16分)W、M、X、Y、Z、Q是原子序数依次增大的短周期元素,X、Y是金属元素,X的焰色呈黄色。六种元素核电荷数之和为71,W、Q最外层电子数相同,Q的核电荷数是W的2倍。Z的单质和氧化物均为原子晶体。工业上一般通过电解氧化物的方法获得Y的单质。请回答下列问题:
(1)Y的离子结构示意图_____________;M元素在元素周期表中的位置为_______________。
(2)写出电子式并在括号内指出所含化学键的类型:W的单质_____________( );
X与W按原子个数比2:1形成的化合物 _____________( ).
(3)W、M、X、Y、Z、Q原子半径由小到大的顺序为_____________________(用元素符号表示)。
(4)W、M、Q形成的氢化物的稳定性__________________________(用氢化物分子式表示)
Z元素氢化物的分子空间构型___________________。
(5)X、Y、Q的最高价氧化物对应的水化物之间两两均可反应,写出反应的离子方程式,
________________________,________________________,______________________;
(6)写出一个化学反应方程式,证明下列结论:
非金属性M比W强:__________________________________________________________;
非金属性Q比Z强:______________________________________________________________。
(1)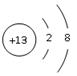 、第2周期,第ⅦA族
、第2周期,第ⅦA族
(2)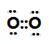 (共价键);
(共价键);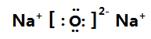 (离子键)。
(离子键)。
(3)r(Na)>r(Al)>r(Si)>r(S)>r(O)>r(F) (4)HF>H2O>H2S;正四面体
(5)H++OH-=H2O;3H++Al(OH)3=Al3++3H2O;Al(OH)3+OH-=AlO2-+2H2O
(6)2F2+2H2O=4HF+O2 Na2SiO3+H2SO4=Na2SO4+H2SiO3
X的焰色呈黄色,则X是Na。单质和氧化物均为原子晶体的是硅,即Z是Si。电解氧化物的方法获得金属Y的单质,说明Y是Al。W、Q最外层电子数相同,则二者属于同一主族,Q的核电荷数是W的2倍,且Q的原子序数大于14,所以W和Q只能是O和S。根据六种元素核电荷数之和为71可判断出M是F。
(2)氧气是由非极性键形成的单质,氧化钠是由离子键形成的离子化合物。
(3)同主族元素自上而下原子半径逐渐增大,同周期元素自左向右原子半径逐渐减小。
(4)非金属性越强,相应氢化物的稳定性越强。硅的氢化物和甲烷相似,是正四面体结构。
(5)氢氧化铝是两性氢氧化物既能溶于强碱,也能溶于酸中。
(6)可以利用单质间的相互置换能力或最高价氧化物对应水化物的酸性强弱来比较非金属性强弱。
