(14分)下表为元素周期表的一部分,请参照元素①-⑩在表中的位置,用化学用语回答下列问题:
| 族
| IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |||
(2)请写出③的最高价氧化物的电子式 。
(3)比较⑤、⑥、⑧的原子半径由大到小的顺序为(用元素符号表示)
(4) 比较③、④、⑨的最高价含氧酸的酸性由强到弱的顺序是(用酸的化学式表示) 。
比较③、④、⑨的最高价含氧酸的酸性由强到弱的顺序是(用酸的化学式表示) 。
(5)写出在元素①-⑩中最高价氧化物对应水化物的最强碱与最强含氧酸之间的化学反应方程式
(6)⑦⑧两元素相比较,金属性较强的是 (填名称),可以验证该结论的实验是 (填编号)。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
(c)将形状、大小相同这两种元素的单质分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
(1)Be (2)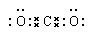 (3) Na >Al > F
(3) Na >Al > F
(4) HNO3>H2CO3 >H2SiO3 ( 或H4SiO4) 。
HNO3>H2CO3 >H2SiO3 ( 或H4SiO4) 。
(5)NaOH + HClO4 ="=" NaClO4 + H2O (6) 镁 ,b.c
考查元素周期表的结构和元素周期律的应用。根据元素在周期表中的位置可判断①~⑩分别是H、Be、C、N、F、Na、Mg、Al、Si、Cl。
(1)略(2)碳的最高价氧化物是CO2,属于共价化合物,电子式为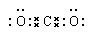 。
。
(3)同周期元素自左向右原子半径逐渐减小,同主族元素自上而下原子半径逐渐增大,所以⑤、⑥、⑧的原子半径大小顺序为Na >Al > F。
(4)非金属性越强,相应最高价氧化物的水化物的酸性就越强,非金属性是N>C>Si,所以酸性是HNO3>H2CO3 >H2SiO3。
(5)在所给元素中最活泼的金属是钠,非金属是氯,所以方程式为NaOH + HClO4 ="=" NaClO4 + H2O。
(6)同周期元素自左向右金属性逐渐减弱,所以金属性较强的是Mg。比较金属性强弱,可以依据最高价氧化物的水化物的碱性强弱,也可以依据和水或酸反应生成氢气的难易程度,或者它们之间的相互置换能力等。放置太久,其表面有氧化膜,所以a不能用来比较金属性强弱。金属没有氢化物,所以答案是bc
