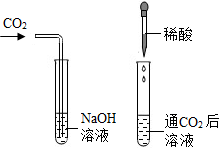
化学复习课上,老师将CO2分别通入澄清的石灰水和NaOH溶液中,我们观察到前者变浑浊,后者无明显现象.CO2和NaOH是否确实发生了化学反应?
(1)我设计了甲、乙两个实验装置来验证,如右图所示,实验现象为:
甲──软塑料瓶变瘪,乙──“瓶吞鸡蛋”
小虎同学认为上述实验是可行的,其共同原理是______.
小余同学提出了质疑,他认为实验还不足以证明CO2与NaOH确实发生了反应,其理由是______.
我思考后,又补充了一个实验来回答,这个实验是______.
(2)小余同学认为可利用与上述实验不同的原理,设计如下实验方案,我来帮他完成:
| 实验步骤 | 实验现象 | 实验结论 | |
| 方法1 |
| ______ | CO2与NaOH确实发 生了化学反应 |
| 方法2 | ______ | ______ |
(3)由此探究,我得到的启示是______.
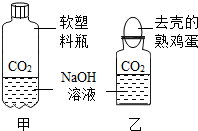
(1)图甲、图乙,在密闭的容器内使氢氧化钠溶液吸收二氧化碳气体,容器内气体减少压强减小.图甲中的塑料瓶变瘪,图乙中的鸡蛋落入瓶中,都是在密闭的体系里消耗CO2,使气体压强减小,从而观察到明显现象.
故答:在密闭的体系里消耗CO2,使气体压强减小;
由于氢氧化钠溶液中含有大量的水,气体二氧化碳不但能溶于水且可以和水发生反应,因此二氧化碳气体的减少原因在此又难以确切判断:究竟是CO2溶于水使气压减小的结果,还是CO2与NaOH反应使气压减小的结果.
故答:NaOH溶液中有水,CO2又能溶于水且可以与水反应;
为了说明二氧化碳的减少和氢氧化钠有很大关系,可取同量的水做对比实验,会发现仅是水,气体减少的体积明显小于氢氧化钠溶液.做一个对比实验:取一个与甲装置同样大小和质地的软塑料瓶,充满CO2后,注入与NaOH溶液体积相同的水,振荡,比较瓶子变瘪的程度即可判断.
故答:取一个与甲装置同样大小和质地的软塑料瓶,充满CO2后,注入与NaOH溶液体积相同的水,振荡,比较瓶子变瘪的程度;
(2)可以采取验证溶液中含有碳酸钠的方法说明二氧化碳与氢氧化钠发生了反应.虽然碳酸钠溶液呈碱性,但反应前的氢氧化钠溶液也呈碱性,因此不能使用酚酞变红的方法来检验是否生成碳酸钠.可以考虑常用的碳酸盐的检验方法来实现检验.如方法一滴加稀盐酸,也可以向反应后溶液中滴加氯化钙溶液(或氯化钡、氢氧化钡等溶液),使溶液中的碳酸钠变成沉淀.
故答:
| 实验步骤 | 实验现象 | 实验结论 | |
| 方法1 | 有气泡产生 | ||
| 方法2 | 将CO2通入NaOH溶液后,再向溶液中滴加CaCl2溶液【或石灰水或BaCl2溶液或Ba(OH)2溶液】【也可仿照方案一的图示】 | 出现白色浑浊(或产生白色沉淀) |
(3)一些反应发生时会因无明显现象而无法判断反应是否发生,此时,简单地实验方法不能得到明确的结论,需要认真设计现象明显的实验或通过对比实验来探究.
故答:对于无明显现象的化学反应,可通过改变实验装置,创新的情境来观察明显的反应现象判断反应的发生.或对比实验是学习化学,开展科学探究的有效方法.