化学兴趣小组对某品牌牙膏中碳酸钙含量进行以下探究.
查得资料:该牙膏摩擦剂主要由碳酸钙、氢氧化铝组成;其他成分遇到盐酸时无气体生成.进行实验:利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定B中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数.
依据实验过程回答下列问题:
(1)准确称取8.00g样品三份,进行测定,测得BaCO3平均质量为3.94g.则样品中碳酸钙的质量分数为______.
(2)若计算值比实际值偏小,分析其原因______;若计算值比实际值偏大,分析其原因______;改进措施是______.
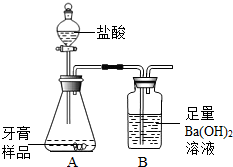
(1)由于碳酸钙与盐酸反应生成二氧化碳,二氧化碳与氢氧化钡生成碳酸钡沉淀的方程式分别是:CaCO3+2HCl═CaCl2+H2O+CO2↑;Ba(OH)2+CO2═BaCO3↓+H2O,所以可建立CaCO3→CO2→BaCO3的关系式;
设碳酸钙的质量分数为x
CaCO3→CO2→BaCO3
100 197
8g×x 3.94g
=100 8g×x 197 3.94g
x=25%
(2)如果计算的实际值偏小,可能是二氧化碳未参与反应,有可能是锥形瓶中残留的二氧化碳导致的问题;若计算值比实际值偏大,则可能是空气中CO2通过导管进入装置B,导致碳酸钡质量变大,改进的方法是在在B装置进出口加洗气装置,以防止空气中的二氧化碳进入装置;
故答案为:(1)25%;
(2)反应生成的CO2没有被Ba(OH)2溶液全部吸收(锥形瓶中残留);空气中CO2进入装置B;在B装置进出口加洗气装置.
