问题
填空题
(8分)下表列出了①~⑥六种元素在元素周期表中的位置。
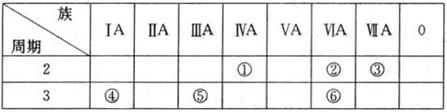
请回答下列问题:
(1)①、②、③三种元素相比较,非金属性最强的是__ __(填写元素符号);
(2) ②、⑥两种元素的原子半径大小为:② ⑥(填“<”或“>”);;
(3) 元素①的原子结构示意图 ;
(4)④、⑤两种元素的最高价氧化物对应的水化物在溶液中相互反应的离子方程式是
______________ ____________。
答案
(1)F (2)<(3)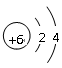 (4)Al(OH)3+OH-=AlO2-+2H2O
(4)Al(OH)3+OH-=AlO2-+2H2O
考查元素周期表的结构和元素周期律的应用。根据元素在周期表中的位置可判断①~⑥分别为C、O、F、Na、Al、S。
(1)同周期元素自左向右非金属性逐渐减弱,所以非金属性最强的是F。
(2)同主族元素自上而下原子半径逐渐增大,所以S的原子半径大于O的原子半径。
(3)C的原子序数是6,所以原子结构示意图为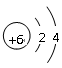 。
。
(4)④、⑤两种元素的最高价氧化物对应的水化物分别是氢氧化钠和氢氧化铝,氢氧化铝是两性氢氧化物能溶于强碱,方程式为Al(OH)3+OH-=AlO2-+2H2O。
