(13分)下列是部分短周期中第二、第三周期元素的原子半径及主要化合价。
| 元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(nm) | 0.186 | 0.160 | 0.152 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
| 主要化合价 | +1 | +2 | +1 | +3 | +5、 -3 | +7、 -1 | +5、 -3 | -2 |
小题1:⑧在元素周期表中的位置是(周期、族) 。
小题2:在这8种元素的最高价氧化物的水化物中,酸性最强的是 (填化学式)。
小题3:①元素和⑥元素形成化合物的电子式是 。
小题4:写出①和④的最高价氧化物对应水化物反应的离子方程式:
。
小题5:②、④、⑤、⑥的简单离子的离子半径由大到小的顺序是: > > > 。(填离子符号)
小题6:比较⑤、⑦气态氢化物的稳定性 > (用分子式表示)
小题7:下列叙述中不正确的是 (填字母)。
A.③、④处于不同周期
B.⑥在同主族元素中非金属性最强
C.⑤元素与⑦元素两者核电荷数之差是8
D.①与⑧形成的化合物只含有离子键
小题1:第二周期第ⅥA族
小题1:HClO4 小题1: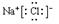
小题1:Al(OH)3+OH-===AlO2-+2H2O
小题1:P3->Cl->Mg2+>Al3+
小题1:NH3>PH3
小题1:ABC
考查元素周期律的应用。根据元素的主要化合价核外原子半径的大小可知①~⑧分别为Na、Mg、Li、Al、P、Cl、N、O。
(3)钠和氯形成的化学键是离子键,电子式为 。
。
(4)氢氧化铝是两性氢氧化物,能溶于强碱氢氧化钠中,生成偏铝酸钠和水
(5)核外电子排布相同的微粒,其微粒半径随原子序数的递增而逐渐减小,所以离子半径大小顺序为P3->Cl->Mg2+>Al3+。
(6)同主族元素自上而下非金属性逐渐减弱,相应氢化物的稳定性逐渐减弱,所以NH3>PH3。
(7)锂位于第二周期,铝是第三周期,A周期氯是第ⅦA,同主族中非金属性最强的是氟,B不正确。N和P的核电荷数之差是8,C不正确。O和Na形成的过氧化钠中含有非极性键和离子键,D不正确。答案选BCD。
