问题
问答题
我区某盐湖生产天然碱,天然碱的主体成份是碳酸钠,还含有少量的食盐和泥沙.为了测定天然碱中碳酸钠的质量分数,现设计了甲、乙两种不同的实验操作流程方案.
甲方案:
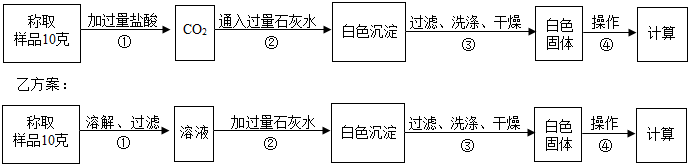
回答:
(1)甲方案中操作①发生化学反应的方程式为______.
(2)乙方案中操作②加入过量石灰水的原因是______.
(3)甲、乙两方案在最后一步计算碳酸钠的质量分数时,还缺少的数据是______.通过操作④可以得到此数据,操作④的名称是______.
(4)比较哪个方案测得的结果更准确?说明原因.______.
答案
(1)碳酸钠和盐酸反应生成氯化钠和二氧化碳气体、水.配平即可.
故答案为:Na2CO3+2HCl=2NaCl+CO2↑+H2O
(2)实验的关键是保证碳酸钠全部转换为碳酸钙沉淀,所以要求加入的石灰水必须过量,以使碳酸钠全部反应.
故答案为:使Na2CO3全部转化为沉淀
(3)根据实验流程可知要计算出碳酸钠的含量,必须通过最终得到的白色固体碳酸钙的质量来进行计算,所以实验中两种方案都没有测定白色固体的质量,应称量固体的质量.
故答案为:白色固体的质量、称量.
(4)测定混合物中组成的含量常采用两种方法,一种是转换为气体,利用测气体的体积或气体转换为沉淀;另一种方法是转换为沉淀.第一种方法的缺点是残留在装置中气体不会被完全吸收,导致误差.
故答案为:乙方案,原因是甲方案中通过气体CO2转化为CaCO3沉淀过程中CO2不易吸收完全,使测定结果数值偏低.
