问题
填空题
(每空1分,共9分)A、B、C、D四种元素的最高正价依次为1、4、5、7,其核电荷数按B、C、D、A的次序增大;已知B原子的次外层电子数为2,C、D、A原子的次外层电子数均为8;A原子核外电子总数不超过20。试回答:
(1)各元素符号为:A_____B_____C_____D_____
(2)写出B、D最高价氧化物对应水化物的分子式: _ __、____,并比较其酸性强弱:_________
(3)写出分子BD4的电子式:
(4)用电子式表示AD的形成过程:
答案
(1)K、C、P、Cl (2)H2CO3 HClO4 HClO4>H2CO3
(3)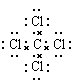 (4)
(4)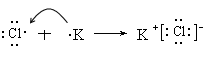
考查原子核外电子的排布规律及元素周期律的应用。
A、B、C、D四种元素的最高正价依次为1、4、5、7,则A、B、C、D四种元素分别属于第IA、ⅣA、ⅤA、ⅦA。B原子的次外层电子数为2,则B是C。C、D、A原子的次外层电子数均为8, A的原子序数最大,且不超过20,所以A是K,则D是Cl,C是P。非金属性越强,最高价氧化物的水化物的酸性就越强,所以酸性强弱是HClO4>H2CO3。四氯化碳是由极性键形成的共价化合物,电子式为 。氯化钾是离子键形成的离子化合物,其形成过程可表示为
。氯化钾是离子键形成的离子化合物,其形成过程可表示为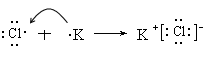 。
。
