雷利是英国物理学家,他曾用以下两种方法测定氮气的密度.
方法一:将除去水蒸气和二氧化碳的空气通过烧红的有铜屑的玻璃管,将空气中的氧气全部除去,则得氮气的密度为1.257g/L.
方法二:将氨气通过赤热的装有氧化铜的玻璃管,生成氮气和水蒸气,除去水蒸气后测得氮密度为1.2508g/L.
回答下列问题:
(1)方法二中发生反应的方程式为:______.
(2)为除去空气中的水蒸气和二氧化碳,可供选择的装置如下:
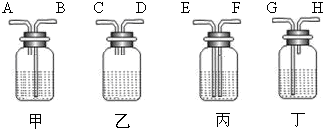
如果气体流向自左向右,在你选用的装置中,导管口应如何连接(各接口用图中字母表示)______各瓶中应盛放什么物质?______
(3)两种方法所测定的氮气密度数值不同,其原因可能是:______.
(1)氨气能与氧化铜反应生成铜、氮气和水,根据元素质量守恒定律,写出其化学方程式为:
2NH3+3CuO
N2+3Cu+3H2O; △ .
(2)除去空气中的水蒸气和二氧化碳,可以使用氢氧化钠溶液和浓硫酸,需要先除去二氧化碳后进行气体的干燥,这两个过程都需要导气管底进上出,并且底进的导气管要插入液体中,故答案应为B→A→G→H;其瓶中甲盛氢氧化钠溶液,丁盛浓硫酸;
(3)使用除去空气中二氧化碳和水蒸气以及氧气的方法测定氮气的密度,由于含有稀有气体,会对结果有一定的影响,而使用氨气与氧化铜反应除去水测定的出纯氮气的密度,比较精确;两种方法所测定的氮气密度数值不同,其原因可能是:空气中含少量的分子量比氮气大的气体,使方法一的结果偏高.
故答案为:
(1)2NH3+3CuO
N2+3Cu+3H2O; △ .
(2)B→A→G→H;甲盛NaOH 溶液,丁盛浓硫酸;
(3)空气中含少量的分子量比氮气大的气体,使方法一的结果偏高.
