过氧化钠(Na2O2)是一种淡黄色的粉末,通常情况下跟水、二氧化碳、盐酸都能发生反应生成氧气.小超同学设计了如下验证过氧化钠与水、二氧化碳反应的实验.
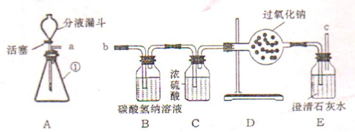
(1)仪器①的名称是______.在①中加入Na2O2,分液漏斗中加入水,打开活塞,出现大量气泡.将______伸到a处,观察到______的现象,证明生成了氧气.
(2)若A装置中加入石灰石和盐酸,连接a、b后,打开活塞,在c处用实验(1)的方法同样证明生成的气体是氧气.设计B、C装置的目的是净化二氧化碳气体,其中的作用是除去二氧化碳中混有的氯化氢,则B中的化学方程式是______;若将B、C位置互换,其结果是______.
(3)若用A装置制取氧气,需在①中加入二氧化锰,那么在分液漏斗中应加入______(填化学式),此反应中二氧化锰是______.
金额:(1)①是锥形瓶;确定CO2与Na2O2反应产生的气体是氧气的方法:把带火星的木条靠近a处导管口,看到木条复燃;
(2)用NaHCO3吸收HCl气体的化学方程式为:NaHCO3+HCl═NaCl+H2O+CO2↑;B装置吸收HCl气体,C装置的作用是干燥二氧化碳,如果将B、C两瓶内的液体互换,就起不到干燥作用了,会使二氧化碳中混有水蒸气,而二氧化碳和水都能与过氧化钠反应产生氧气,因此无法证明二氧化碳也能够与过氧化钠产生氧气,会产生干扰;
(3)制取氧气是过氧化氢溶液和二氧化锰作用,其中二氧化锰是催化剂.
故答案为:(1)锥形瓶;带火星的木条;木条复燃;(2)NaHCO3+HCl═NaCl+H2O+CO2↑;通向D装置中的CO2气体仍有水蒸气,无法证明氧气是由二氧化碳和过氧化钠反应产生的;(3)H2O2;催化剂.
