现有含杂质的高锰酸钾样品(杂质不参加反应),为了测定该样品中高锰酸钾的质量分数,某同学称取1g该高锰酸钾样品,利用如图所给出的实验装置进行实验.请你回答有关问题:
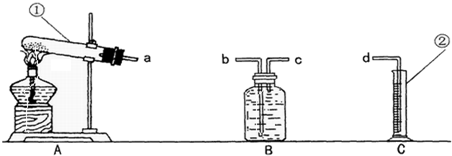
(1)写出标号①②仪器的名称:①______;②______.
(2)写出加热高锰酸钾制氧气的化学方程式:______;
(3)为了完成实验,各装置的正确连接顺序是:(填接口的字母)a→____________→d.
(4)实验过程发现B瓶中的水变红了,原因是:______,为避免此情况出现,实验时应______.
(5)实验结果测得B瓶排出水的体积为50mL,若此状况时氧气的密度为1.28g/L,则生成氧气的质量为______,该高锰酸钾样品中高锰酸钾的质量分数为______.
(1)要熟记常见仪器的名称和用途;
(2)写方程式要注意一写二配三注明四等号.用高锰酸钾制氧气,反应物是高锰酸钾,生成物是锰酸钾、二氧化锰、氧气,配平方法是用观察法配平,氧气后面标上上升符号;
(3)测量气体体积是利用气体的压强把水压入量筒中,进入水的体积是多少,测量的气体体积就是多少;所以制得的氧气要从c端进入,否则气体会从上边跑出,而不能把水压出;
(4)用高锰酸钾制氧气需在试管口放棉花团,防止高锰酸钾颗粒随着气流进入导管,进入B瓶中溶于水,溶液就是红色了;
(5)生成氧气的质量为:0.05L×1.28g/L=0.064g;设要生成0.064g氧气需要参加反应的高锰酸钾的质量为X则:
2KMnO4
K2MnO4+MnO2+O2↑ △ .
316 32
X 0.064g
根据:
=316 32
解得X=0.632g所以该高锰酸钾样品中高锰酸钾的质量分数为:X=X 0.064g
×100%=63.2%,0.632g 1g
故答案为:(1)①试管;②量筒;(2)2KMnO4
K2MnO4+MnO2+O2↑;(3)c;b;(4)高锰酸钾颗粒进入B瓶溶于水;在试管口放棉花团;(5)0.064g;63.2%. △ .