A、B、C、D、E均为短周期主族元素,且原子序数依次递增。A、E同主族,B、D同周期且B和D最外层电子数之和为10;D为自然界含量最多的元素;A与D可形成A2D、A2D2共价化合物。请回答:
(1)C的气态氢化物的电子式为___ ___,其水溶液显 性。
(2)B、C、D气态氢化物稳定性由强到弱的顺序是_____ ___________(用化学式表示)。
(3)与E同周期的元素中,金属性最弱的金属元素名称是 ,原子结构示意图为: ,其最高价氧化物对应的水化物与E的最高价氧化物对应的水化物的溶液反应的离子方程式为 。
(4)E、C两元素的最高价氧化物对应水化物的稀溶液各0.1mol,恰好完全反应,放出5.73kJ的热量,写出此反应的热化学方程式: 。
(1)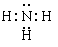 ;碱(2)H2O>NH3>CH4
;碱(2)H2O>NH3>CH4
(3)铝;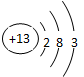 ;OH- +Al(OH)3==AlO2-+2H2O
;OH- +Al(OH)3==AlO2-+2H2O
(4)NaOH(ag)+HNO3(ag)==NaNO3(ag)+H2O(l) △H=-57.3kJ/mol
考查元素周期表的结构及元素周期律的应用。
D为自然界含量最多的元素,则D是氧。B和D最外层电子数之和为10,且B的原子序数小于氧的,所以B是碳,则C是氮元素。A的原子序数最小,且A与D可形成A2D、A2D2共价化合物,所以A是氢元素。A、E同主族,因此E是钠。
(1)氨气是极性键形成的共价化合物,其水溶液显碱性。
(2)非金属性越强,相应氢化物的稳定性就越强,非金属性是O>N>C,所以氢化物的稳定性就是H2O>NH3>CH4。
(3)氢氧化铝是两性氢氧化物能溶于强碱中,离子方程式为OH- +Al(OH)3==AlO2-+2H2O。
(4)E、C两元素的最高价氧化物对应水化物分别是氢氧化钠和硝酸,热化学方程式为NaOH(ag)+HNO3(ag)==NaNO3(ag)+H2O(l) △H=-57.3kJ/mol。
