某Na2CO3样品中混有一些NaCl,用下列装置测定其纯度:
实验操作过程如下:把准确称量的10gNa2CO3样品装入B瓶后,将B装置分别与试管A和C瓶相连,打开开关K,从a处缓缓鼓入空气几分钟后,将开关K关闭,再将已称量过的干燥管D与瓶C连接,然后将足量稀H2SO4缓缓注入B瓶中.待反应完全后,再次打开开关K缓缓鼓入空气几分钟,最后称量干燥管D,增重3.3g.
回答:
(1)A瓶的作用是______.
(2)B瓶中反应的化学方程式是______.
(3)干燥管D增加的是______(写化学式)的质量,由此可推算出样品中Na2CO3的质量分数是______.
(4)反应前第一次鼓入空气的作用是______,反应后再次鼓入空气的作用是______,若反应后不鼓入空气,对测定结果的影响是______.(填“偏大”或“偏小”)
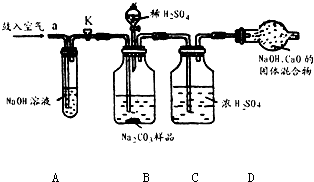
(1)A瓶氢氧化钠可以与二氧化碳反应,故A瓶的作用是除去空气中的二氧化碳;故答案为:吸收空气中的CO2
(2)碳酸钠和硫酸反应生成硫酸钠和水和二氧化碳,配平即可;故答案为:Na2CO3+H2SO4=Na2SO4+CO2↑+H2O
(3)装置D增加的质量就是二氧化碳的质量,设样品中Na2CO3的质量分数是x
Na2CO3+H2SO4=Na2SO4+CO2↑+H2O
106 44
10gx 3.3g
=106 10gx
x=79.5%44 3.3g
故答案为:CO2 79.5%
(4)反应前第一次鼓入空气的作用是:除去整个装置内的空气;反应后再次鼓入空气的作用是:使B、C装置中的CO2气体全部进入D;若反应后不鼓入空气,对测定结果的影响是偏小.故答案为:除净B、C装置中的空气;使B、C装置中的CO2气体全部进入D;偏小
