(13分)下表为长式周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)元素⑩的基态原子的价电子排布式为 。
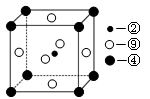
(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如图所示(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为 (用对应的元素符号表示),与④距离相等且最近的⑨有 个。
(3)元素②的一种氢化物(分子中含有6个原子)是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是 。
A.分子中含有分子间的氢键
B.属于含有极性键的非极性分子
C.只含有4个sp1-s的σ键和1个p-p的π键
D.该氢化物分子中②原子采用sp2杂化
(4)下图所示为血红蛋白和肌红蛋白的活性部分(血红素)的结构式。此结构片段中含有的化学键有 (填序号)。
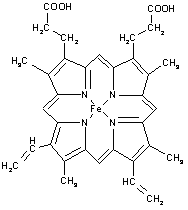
A.离子键 B.金属键 C.极性键 D.非极性键
E.配位键 F.氢键 G.σ键 H.π键
(5)下表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据。

请回答:表中的金属元素是 (填字母);若A、B、C为原子序数依次增大的同周期相邻元素,表中显示B比A和C的第一电离能都略大,其原因是
。
(1)3d104s1 (2)MgCNi3或CMgNi3 12 (3)B D
(4)CDEGH (5)D E F B的np轨道上的电子半满,能量比A和C低,自身更稳定,所以第一电离能比A和C大
考查元素周期表的结构,根据元素在周期表中的位置可知①~⑩分别为H、C、O、Mg、Al、S、Cl、Ca、Ni、Cu。
(1)铜原子的最外层只有1个电子,其价电子排布式为3d104s1。
(2)Mg位于8个顶点上,晶胞中含有的原子数是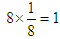 ,Ni位于6个面的面心处,含有的原子数是6×1/2=3,碳原子位于体心处,全部属于该晶胞,所以化合物的化学式为MgCNi3。与④距离相等且最近的⑨位于面的面心处,共有3×8/2=12。
,Ni位于6个面的面心处,含有的原子数是6×1/2=3,碳原子位于体心处,全部属于该晶胞,所以化合物的化学式为MgCNi3。与④距离相等且最近的⑨位于面的面心处,共有3×8/2=12。
(3)乙烯的产量可以用来衡量石油化工发展水平的标志,所以该氢化物是CH2=CH2,乙烯分子是平面型结构,属于非极性分子。碳原子是sp2杂化,含有5个σ键和1个π键,所以答案选B和D。
(4)根据结构式可知,分子含有的化学键有极性键、非极性键。铁还含有配位键,分子含有单键和双键,所以有σ键和π键,答案选CDEGH。
(5)金属性越强,第一电离能越小。DEF的第一电离能最小,且非常接近,所以DEF是金属。
由于B的np轨道上的电子半满,能量比A和C低,自身更稳定,所以第一电离能比A和C大。
