化学课上老师为同学们制作了一个热气腾腾的“黑面包”,实验过程如图所示:

同学们对这个蓬松的黑面包产生了极大兴趣,探究活动立即展开:
(1)甲组同学用手触摸烧杯外壁,提出问题:烧杯为什么会这么热?请你结合实验过程和已有知识给他们一个合理的解释______.
(2)乙组同学也提出了探究问题,并完成了实验探究过程.请你参与提出问题:黑色固体物质是什么?
猜想与假设:______
制定计划并进行实验:
| 实验步骤 | 实验现象 | 结论解释 |
提出问题:蜂窝内的气体成分是什么?
查阅资料:C+2H2SO4(浓)
2SO2↑+CO2↑+2H2O;SO2+Ca(OH)2→CaSO3↓+H2O△
SO2是一种无色有刺激性气味的气体,能使品红溶液褪色
猜想与假设:蜂窝内的气体可能含有SO2和CO2,一定含有水蒸气
设计实验:
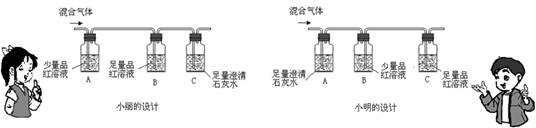
你不同意谁的设计方案?请表述理由______(有几点答几点)确认混合气体中含有二氧化硫观察到的现象是______.
(1)浓硫酸具有吸水性溶于水会放出热量,导致烧杯温度升高;
(2)由蔗糖的成分可知它含有碳氢氧三种元素,而浓硫酸具有强氧化性会使蔗糖转化成黑色的碳,要对其进行验证需经过:除杂质→加热→与氧气的反应→验证产物四步,其中验证产物即验证二氧化碳是否生成,一般采用澄清石灰水进行实验验证;
(3)小明在设计方案时现验证了二氧化碳的存在,但由题干知二氧化硫也能使石灰水变浑浊,所以开始检验二氧化碳时二氧化硫会造成干扰,且小明B装置借口错误,这样不能导出气体,最后通入到品红中由于开始先通入到了氢氧化钙溶液,因SO2+Ca(OH)2=CaSO3↓+H2O所以也不能检测到SO2是否存在,而小丽的设计较合理,有效地避免了以上问题,因为二氧化硫能使品红褪色,所以混合气体开始通入品红中时能使品红褪色.
故答案为:(1)浓硫酸遇水放出大量热(2)黑色固体物质可能是碳;
| 实验步骤 | 实验现象 | 结论解释 | ||||
| 1.用镊子取一小块“面包”放入盛有蒸馏水的烧杯中,充分搅拌,过滤、洗涤、干燥. 2.将干燥后的黑色固体放入燃烧匙中,用酒精灯加热至红热. 3.将燃烧匙伸入盛满氧气的集气瓶中. 4.向集气瓶内倒入适量澄清石灰水. | 黑色固体燃烧,发白光,放出大量热 澄清石灰水变浑浊 | 洗去黑色固体中含有的杂质 C+O2
CO2+Ca(OH)2=CaCO3↓+H2O |
小丽判断二氧化硫存在的现象是A装置中品红溶液褪色.
