(10分)铝、铁、铜是人类广泛使用的三种金属,与我们生活息息相关。
(1)在空气中 制品(填“铝”或“铁”)更耐腐蚀,原因是 。
(2)现有这三种金属,用下列试剂验证金属活动性顺序,能达到目的是 (填
序号)。
A.氯化铜溶液 B.氯化亚铁溶液 C.氯化铝溶液
(3)金属与酸反应的剧烈程度与许多因素有关。下图是20℃时相同质量的铁粉、铁片、
铝粉、铝片分别与足量稀盐酸完全反应,产生氢气的质量与时间的关系图。
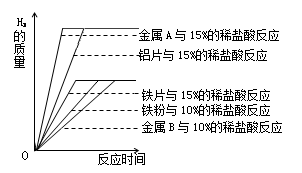
①写出铝与15%的盐酸反应的化学方程式 。
②根据上图推测,金属A是 (填字母序号)。
a.铝片 b.铝粉 c. 铁片 d.铁粉
③金属B与10%的稀盐酸反应的现象是:产生气泡、固体量减少、 。
④图中铝片、铁片分别与15%的稀盐酸完全反应,产生的氢气质量之比为 。
由此可以分析、归纳出影响金属与酸反应速率的因素有:金属的种类、 和酸的浓度。
(4)某钢铁厂每天需消耗5000t含Fe2O380%的赤铁矿石,该厂理论上可日产含铁98%的生铁的质量是多少?(精确到小数点后1位)计算过程 。
(1)铝 铝表面被空气氧化生成了致密的氧化层,可防止铝进一步被腐蚀
(2)B (3)①2Al+6HCl=2AlCl3+3H2↑ ② b ③溶液渐渐变成浅绿色 ④28:9
金属与酸的接触面积 (其他合理答案也可)。(4)2857.1t
题目分析:(1)铝虽然较铁活泼,在空气中却更稳定,是因为铝表面被空气氧化生成了致密的氧化层,可防止铝进一步被腐蚀,而铁的氧化物却比较疏松,不能阻止内部的铁被氧化腐蚀。
(2)氯化铝溶液和氯化铜溶液无法区分三种金属的活泼性,而氯化亚铁溶液和铝反应可以析出铁单质,而铜和氯化亚铁溶液不反应,没有反应现象,从而得出三种金属的活动性顺序。
(3)①铝与盐酸反应本质上是与里面的氯化氢溶质发生的置换反应。②酸是过量的,相同质量的不同金属不可能最终产生相同质量的氢气,最终相同说明是同一种金属,但是反应速率比铝片快,只能是铝粉,接触面积较大,故反应速率较快。③由坐标图金属B是铁片,由反应方程式知反应后所得溶质为氯化亚铁,所以随着反应的进行溶液为绿色。④由方程式知,相同原子个数的铝和铁产生的氢气质量比为3:2,而相同原子个数的两种金属质量比为27:56,故相同质量的两种金属产生氢气的质量比为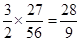 ;将金属磨成粉末可以极大地增大金属与酸的接触面积,从而增大反应速率。
;将金属磨成粉末可以极大地增大金属与酸的接触面积,从而增大反应速率。
(4)只要算出赤铁矿之中含有的铁的质量就行了:5000t×80%×70%/98%=2857.1t。
点评:这种题目主要是把坐标曲线看懂,然后联系题干,要注意和整个题目的联系。
