(7分)金属在生产和生活中应用广泛。
(1)下列生活用品中,主要利用金属导热性的是_______(填字母序号)。




A.铁制水龙头
B.铜制火锅
C.铝制易拉罐
D.黄金饰品(2)铁制品容易锈蚀,铁生锈的条件是 。工业上用一氧化碳还原氧化铁的化学方程式为 。
(3)化学小组在实验结束后,进行了如下废液处理:
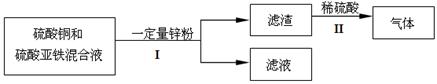
①步骤Ⅰ中的操作名称是___________。
②写出II中一定发生反应的化学方程式为 ____________ 。
③滤液中的溶质组成是 (写出所有可能)。
(1)B
(2)与氧气、水同时接触 3CO+Fe2O3 2Fe+3CO2
2Fe+3CO2
(3)①过滤 ②Fe + H2SO4 = FeSO4 + H2↑
③ZnSO4或ZnSO4和FeSO4 (2分,错答、漏答0分)
题目分析:(1)铜制火锅主要利用金属导热性。
(2)铁制品容易锈蚀,铁生锈的条件是与氧气、水同时接触;工业上用一氧化碳还原氧化铁的化学方程式为3CO+Fe2O3 2Fe+3CO2。
2Fe+3CO2。
(3)①步骤Ⅰ是将固体与液体分离,其操作名称是过滤。
②II中一定发生反应的化学方程式为Fe + H2SO4 = FeSO4 + H2↑。
③锌的活动性强于铁,铁的活动性强于铜,步骤II中,加稀硫酸有气体产生,故若锌是过量的,则锌将全部置换溶液中的铜和铁,滤液中的溶质组成是ZnSO4;若锌的量只能置换铜,或者只你置换铜和部分铁,则滤液中的溶质组成是ZnSO4和FeSO4。
点评:书写化学方程式要遵循客观事实和质量守恒定律两个原则,注意化学式要正确,不要忘记反应条件、气体或者沉淀符号。
金属活动性顺序:K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au。
过滤可以将固体不溶物与液体分离。
