(14分)下表为周期表的一部分,其中的编号代表对应的元素。
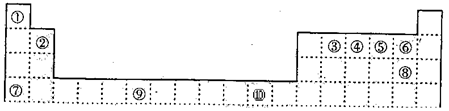
(1)写出上表中的元素⑩原子的外围电子排布式 。
(2)元素⑦与⑧形成的化合物的晶体类型是 。
(3)元素④的第一电离能 (填“>”、“=”或“<”)元素⑤的第一电离能;元素④与元素①形成的X分子的空间构型为 。X沸点高于同族其它元素与元素①形成的化合物的沸点,其原因是 。
(4)第四周期所有元素的基态原子中,4p轨道半充满的是 (请填元素符号,下同),3d轨道半充满的原子是 ,4s轨道半充满的是 。
(5)将过量的X通入含有元素⑩的蓝色硫酸盐溶液中,其离子方程式为 .
(1)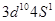 。(1分) (2) 离子晶体。(1分)
。(1分) (2) 离子晶体。(1分)
(3) > ( 1分) 三角锥形 (1分)X分子间易形成氢键 (2分)
(4) As(1分); Cr Mn(2分,各1分); K Cr Cu(3分,各1分)
(5)4NH3 + Cu2+=Cu(NH3)42+( 2分)
根据元素在周期表中的位置可知,①~⑩分别是H、Be、C、N、O、F、K、Cl、Cr、Cu。
(1)根据构造原理可知,铜原子的的外围电子排布式为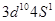 。
。
(2)氯化钾是由离子键形成的离子晶体。
(3)由于氮元素的2p电子属于半充满状态,稳定性强,所以第一电离能大于氧元素的。氨气是三角锥形结构,由于氨气中含有氢键,所以氨气的沸点高。
(4)根据构造原理可知4p轨道半充满的是As,3d轨道半充满的原子是Cr、Mn,4s轨道半充满的是K、Cr、Cu。
(5)氨气和铜离子能形成配位键,所以反应式为4NH3 + Cu2+=Cu(NH3)42+
